Veuillez saisir au moins 3 caractères pour votre recherche.
Περίληψη
Έκδοτο του διαλύτη: νερό PPI
een χωρίς όριο δόσης: Polysorbate 80 | Όριο δόσης:
EEN avec dose seuil : νάτριο
CIP: 3400955057444
Modalités de conservation : Avant ouverture : < 30° durant 36 mois (Conserver à l'abri de la lumière, Conserver dans son emballage, Ne pas congeler)
Μορφές και παρουσιάσεις |
Σύνθεση |
| από Flacon | |
| Vonicog Alfa | 650 UI* |
| ή | 1300 UI* |
Solvant: νερό για ενέσιμα παρασκευάσματα.
Η ειδική δραστηριότητα του Veyvondi είναι περίπου 110 UI του FVW: RCO/mg πρωτεΐνης. | Δοσολογία της δραστηριότητας του συμπαράγοντα ριστοτίνης της ευρωπαϊκής φαρμακοποιίας (FVW: RCO). Η δραστηριότητα του συμπαράγοντα ristocetin του ανθρώπινου παράγοντα Von Willebrand Von Willebrand έχει προσδιοριστεί σε σχέση με τη διεθνή αναφορά για τον συμπυκνωμένο παράγοντα Von Willebrand (WHO).
L'activité du FVW (UI) est mesurée à l'aide du dosage de l'activité du cofacteur de la ristocétine de la Pharmacopée européenne (FVW:RCo). L'activité du cofacteur de la ristocétine du facteur von Willebrand recombinant humain a été déterminée par rapport à la référence internationale pour le concentré de facteur von Willebrand (OMS).
Το Vonicog alfa είναι ένας παράγοντας Von Willebrand ανασυνδυασμένο ανθρώπινο (FVWR). Παράγεται με την τεχνική ανασυνδυασμένου DNA (DNA) σε κύτταρα ωοθηκών του κινεζικού χάμστερ (CHO) χωρίς να προσθέτουν εξωγενές πρωτεΐνες ανθρώπινης ή ζωικής προέλευσης κατά τη διάρκεια των σταδίων της κυτταρικής καλλιέργειας, του καθαρισμού ή της τελικής διατύπωσης.
Το προϊόν περιέχει μόνο αμελητέες ποσότητες παράγοντα VIII της ανθρώπινης ανασυνδυασμένης πήξης (≤ 0,01 της FVIII/UI του FVW: RCO), που προσδιορίζεται σύμφωνα με τη χρωμογενή μέθοδο της δοσολογίας του παράγοντα VIII (FVIII) της Ευρωπακοποϊίας.
Παραγγελία με περιβόητο αποτέλεσμα:
Κάθε μπουκάλι 650 UI σκόνης περιέχει 5,2 mg νατρίου. | Περιέχει 10,4 mg νατρίου.
Chaque flacon de 1 300 UI poudre contient 10,4 mg de sodium.
* Μετά την ανασύσταση με τα 5 mL διαλύτη (σκόνη στα 650 IU) ή 10 ml διαλύτη (σκόνη στα 1300 IU) που παρέχεται, το Veyvondi περιέχει περίπου 130 UI/ml Vonicog Alfa. | Η αιμορραγία ή η αιμορραγία της χειρουργικής προέλευσης σε ενήλικες (ηλικίας 18 ετών και άνω) με ασθένεια Willebrand (MVW), όταν η θεραπεία με δεσμοπρεσίνη (DDAVP) μόνο είναι αναποτελεσματική ή αντενδείκνυται.INDICATIONS |
δοσολογία και τρόπος χορήγησης |
Σύνδεση για πρόσβαση σε αυτό το περιεχόμενο
Αντενδείξεις |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Σε ασθενείς με ενεργό αιμορραγία, συνιστάται να συν-διαχειρίζεται ένα FVIII με Veyvondi ως θεραπεία πρώτης γραμμής και σύμφωνα με τα ποσοστά FVIII (|| 690 cf Posologie et Mode d'administration).
Τοποδυτικότητα:
Για να βελτιωθεί η ανιχνευσιμότητα των βιολογικών φαρμάκων, πρέπει να καταγραφεί το όνομα και ο αριθμός παρτίδας του διαχειριζόμενου προϊόντος.
Αντιδράσεις υπερευαισθησίας:
Des réactions d'hypersensibilité (incluant l'anaphylaxie) sont possibles. Les patients et/ou leurs aidants doivent être informés des signes précoces de réactions d'hypersensibilité, tels que tachycardie, oppression thoracique, sibilances et/ou détresse respiratoire aiguë, hypotension, urticaire généralisée, prurit, rhino conjonctivite, angiœdème, léthargie, nausées, vomissements, paresthésie, impatiences, qui peuvent évoluer en choc anaphylactique. En cas de choc anaphylactique, le traitement médical standard devra être instauré.
Οι ασθενείς θα πρέπει να παρακολουθούνται στενά προκειμένου να ανιχνευθούν ένα πιθανό σύμπτωμα, καθ 'όλη τη διάρκεια της έγχυσης. Εάν εμφανίζονται σημεία και συμπτώματα σοβαρών αλλεργικών αντιδράσεων, διακόπτουν αμέσως τη χορήγηση του Veyvondi και παρέχουν την κατάλληλη φροντίδα στον ασθενή.
Μια επαρκής θεραπεία και ο ιατρικός εξοπλισμός πρέπει να είναι άμεσα διαθέσιμα για να αντιμετωπίσουν μια πιθανή αναφυλακτική αντίδραση, ιδίως σε ασθενείς με ιστορικό αντιδράσεων αλλεργικών.
Το Veyvondi περιέχει αμελητέες ποσότητες ανοσοσφαιρίνης G ποντικού (Muigg) και πρωτεΐνες χάμστερ (≤ 2 ng/ui του Veyvondi). Οι ασθενείς που υποβλήθηκαν σε θεραπεία με αυτό το φάρμακο μπορούν να αναπτύξουν αντιδράσεις υπερευαισθησίας σε αυτές τις μη ανθρώπινες πρωτεΐνες θηλαστικών.
Το Veyvondi περιέχει αμελητέες ποσότητες ανασυνδυασμένης πήξης VIII.
Θρομβόζη και εμβολή:
Υπάρχει κίνδυνος για την εμφάνιση θρομβοεμβολικών γεγονότων, ιδιαίτερα σε ασθενείς με γνωστούς κλινικούς ή οργανικούς παράγοντες κινδύνου για τη θρόμβωση, συμπεριλαμβανομένων των χαμηλών επιπέδων ADAMTS13. Κατά συνέπεια, οι ασθενείς που διατρέχουν κίνδυνο θα πρέπει να παρακολουθούνται προκειμένου να ανιχνευθούν τα πρώτα σημάδια θρόμβωσης και τα αντι-θρομβο-ενυματικά προφυλακτικά μέτρα πρέπει να καθορίζονται σύμφωνα με τις τρέχουσες συστάσεις και το πρότυπο περίθαλψης.
Ασθενείς που απαιτούν συχνές δόσεις Veyvondi σε συνδυασμό με τον παράγοντα VIII ανασυνδυάσει FVIII: C για να αποφευχθεί η υπερβολική αύξηση, πιθανόν να αυξήσουν τον κίνδυνο θρομβωτικών συμβάντων.
Όλοι οι FVIII που χορηγούνται με Veyvondi πρέπει να είναι ένα προϊόν που περιέχει καθαρό FVIII. Οποιαδήποτε συσχέτιση με ένα προϊόν που περιέχει FVIII και FVW θα μπορούσε να αποτελέσει πρόσθετο κίνδυνο θρομβωτικού γεγονότος.
εξουδετέρωση των προπονητών (αναστολείς):
των εξουδετερωτικών αντισωμάτων (αναστολείς) έναντι του παράγοντα Von Willebrand μπορεί να εμφανιστεί σε ασθενείς με νόσο του Willebrand. Εάν ο ρυθμός πλάσματος που αναμένεται για το (FVW: RCO) δεν έχει επιτευχθεί ή εάν η αιμορραγία δεν ελέγχεται παρά τη χορήγηση κατάλληλης δόσης, πρέπει να διεξαχθούν κατάλληλες βιολογικές αναλύσεις προκειμένου να αναζητηθεί η παρουσία αναστολέων παράγοντα von Willebrand. Σε ασθενείς με υψηλό επίπεδο αντισωμάτων εξουδετέρωσης αντι-FVW, η θεραπεία με παράγοντα Von Willebrand μπορεί να είναι αναποτελεσματική και πρέπει να προβλεφθούν άλλες θεραπευτικές επιλογές για να εξασφαλιστεί η αιμόσταση.
Η θεραπεία ασθενών με MVW και με υψηλά επίπεδα αντισωμάτων (λόγω της προηγούμενης θεραπείας από το FVWDP) μπορεί να απαιτεί υψηλότερη δόση για να αντισταθμιστεί η επίδραση των αντισωμάτων. Αυτοί οι ασθενείς μπορούν να αντιμετωπιστούν κλινικά με τη χορήγηση υψηλότερων δόσεων Vonicog Alfa, ως συνάρτηση των φαρμακοκινητικών δεδομένων τους.
Σκέψεις που συνδέονται με τα έκδοχα:
Αυτό το φάρμακο περιέχει 5,2 mg νατρίου ανά φιάλη 650 IU ή 10,4 mg νατρίου ανά φιάλη 1300 IU, που πρέπει να λαμβάνεται υπόψη με 2,2% την μέγιστη ημερήσια πρόσληψη που συνιστάται από το WHO ή 2 g νατρίου για έναν ενήλικα 70 kg και μια δόση 80 IU/kg σωματικού βάρους, η οποία πρέπει να λαμβάνεται υπόψη για ασθενείς που ακολουθεί μια δίαιτα ελέγχου που συνιστάται από το WHO ή 2 g νατρίου για έναν ενήλικα 70 kg και μια δόση 80 IU/kg σωματικού βάρους.
αλληλεπιδράσεις |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
Γονιμότητα/εγκυμοσύνη/θηλασμός |
Το Veyvondi δεν έχει αποτελέσει αντικείμενο μελέτης σχετικά με τις αναπαραγωγικές λειτουργίες στα ζώα.
Εγκυμοσύνη:Η εμπειρία στη θεραπεία των εγκύων γυναικών ή που δεν είναι διαθέσιμες. Το Veyvondi θα πρέπει να χορηγείται μόνο σε έγκυες γυναίκες εάν το φάρμακο έχει αναφερθεί σαφώς, λαμβάνοντας υπόψη ότι ο τοκετός δίνει αυξημένο κίνδυνο αιμορραγικών γεγονότων σε αυτούς τους ασθενείς.
Δεν γνωρίζουμε αν το Veyvondi απεκκρίνεται στο μητρικό γάλα. Κατά συνέπεια, το Veyvondi θα πρέπει να χορηγείται σε γυναίκες με παράγοντα παράγοντα von Willebrand, ο οποίος θηλάζει μόνο εάν το φάρμακο έχει αναφερθεί σαφώς. Οι επαγγελματίες υγείας πρέπει να λαμβάνουν υπόψη τους πιθανούς κινδύνους και να συνταγογραφούν το Veyvondi μόνο εάν είναι απαραίτητο.
Γονιμότητα:Οι επιδράσεις του Veyvondi στη γονιμότητα δεν έχουν καθιερωθεί.
Οδήγηση και χρήση μηχανών |
Ανεπιθύμητες ενέργειες |
Σύνδεση για πρόσβαση σε αυτό το περιεχόμενο
ourdosage |
Aucun symptôme de surdosage n'a été rapporté avec le facteur von Willebrand. Des événements thrombo-emboliques peuvent survenir en cas de surdosage important.
Φαρμακοδυναμική |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
Φαρμακοκινητική |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
SÉCURITÉ PRÉCLINIQUE |
Τα μη κλινικά δεδομένα από συμβατικές μελέτες φαρμακολογίας ασφαλείας, τοξικολογία στην επαναλαμβανόμενη χορήγηση, τη γονιδιοτοξικότητα, την καρκινογένεση και τις αναπαραγωγικές και αναπτυξιακές λειτουργίες δεν έχουν αποκαλύψει ιδιαίτερο κίνδυνο για τους ανθρώπους.
Δεν έχει διεξαχθεί έρευνα σχετικά με την καρκινογένεση, τις διαταραχές της γονιμότητας και της εμβρυϊκής ανάπτυξης. Σε ένα μοντέλο έγχυσης πλακούντα ex vivo humain, Veyvondi n'a pas traversé la barrière placentaire humaine.
ασυμβίβαστες |
Αυτό το φάρμακο δεν πρέπει να αναμειγνύεται με άλλα φάρμακα, με εξαίρεση εκείνα που αναφέρονται στο τμήμαModalités de manipulation et d'élimination.
Μέθοδοι διατήρησης |
για να διατηρηθεί σε θερμοκρασία που δεν υπερβαίνει τους 30 ° C, στην αρχική συσκευασία, προστατευμένη από το φως. Μην παγώσετε.
Μέθοδοι Modeliing/Elimination |
Γενικές οδηγίες:
Οδηγίες για την ανακατασκευή και τη διαχείριση
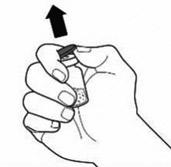 |
1) Αφαιρέστε τα καπάκια από τα μπουκάλια σκόνης Veyvondi και διαλύτη για να εκθέσετε το κέντρο των καουτσούκ.
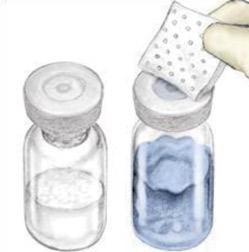 |
2) Απορρίψτε τις κυκλοφοριακές συμφόρησης, σκουπίζοντας τους με μια ξεχωριστή αποστειρωμένη αλκοολική σφραγίδα (ή οποιαδήποτε άλλη προσαρμοσμένη αποστειρωμένη λύση που συμβουλεύεται η θεραπεία γιατρού ή αιμοφιλίας) για μερικά δευτερόλεπτα. Αφήστε να στεγνώσει τις κυκλοφοριακές συμφόρηση πριν από τη χρήση. Τοποθετήστε τα μπουκάλια σε μια επίπεδη επιφάνεια.
3) Ανοίξτε τη συσκευασία της συσκευής Mix2Vial αφαιρώντας πλήρως το απρόσκοπτο χωρίς να αγγίξετε το εσωτερικό της συσκευασίας. Μην αφαιρέσετε τη συσκευή Mix2Vial από τη συσκευασία.
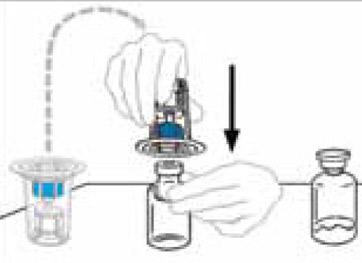 |
4) Επιστρέψτε τη συσκευασία με τη συσκευή Mix2Vial και τοποθετήστε την πάνω από το μπουκάλι διαλύτη. Βάλτε το μπλε πλαστικό διάτρητο στη συσκευή σταθερά και ευθεία στο κέντρο του καλύμματος φιαλιάς διαλύτη. Αφαιρέστε τη συσκευασία από τη συσκευή Mix2Vial κρατώντας την από τις άκρες. Βεβαιωθείτε ότι δεν αγγίζετε το διαφανές πλαστικό διάτρητο. Το μπουκάλι διαλύτη είναι τώρα συνδεδεμένη με τη συσκευή Mix2Vial και είναι έτοιμη να συνδεθεί με το μπουκάλι Veyvondi.
 |
5) Για να συνδέσετε το μπουκάλι διαλύτη με το μπουκάλι Veyvondi, γυρίστε το μπουκάλι διαλύτη και τοποθετήστε το πάνω από το μπουκάλι που περιέχει τη σκόνη Veyvondi. Πλήρως και ευθεία το διαφανές πλαστικό διάτρητο στη φιάλη σκόνης Vyvondi. Αυτό πρέπει να πραγματοποιηθεί αμέσως για να αποφευχθεί η μόλυνση του υγρού από τα μικρόβια. Ο διαλύτης ρέει στο μπουκάλι σκόνης Veyvondi υπό την επίδραση του κενού. Ελέγξτε ότι έχει μεταφερθεί ολόκληρος ο διαλύτης. Μην χρησιμοποιείτε εάν το μπουκάλι δεν είναι πλέον υπό κενό και αν ο διαλύτης δεν ρέει στο μπουκάλι Venyvondi.
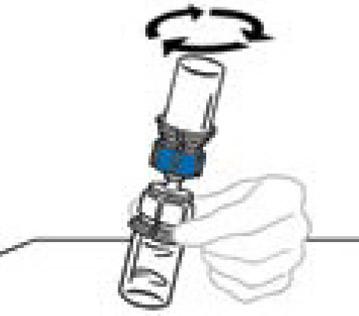 |
6) απαλά και συνεχώς κυματίζει τα συνδεδεμένα μπουκάλια ή αφήστε το ανασυγκροτημένο προϊόν να ξεκουραστεί για 5 λεπτά και στη συνέχεια να το πιπιλίσει απαλά για να διαλύσει πλήρως τη σκόνη. Μην κουνάτε, θα άλλαζε το προϊόν. Μην βάζετε τη λύση στο ψυγείο μετά την ανασυγκρότηση.
 |
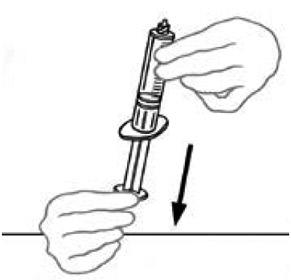
7) Ανάλυση των δύο τμημάτων της μίξης 2 από το άλλο κρατώντας το διαφανές πλαστικό τμήμα που συνδέεται με το μπουκάλι Veyvondi με το ένα χέρι και το μπλε πλαστικό τμήμα της μίξης 2vial συσκευή που συνδέεται με το μπουκάλι διαλύτη του άλλου χεριού. Ξεχωρίστε τα δύο μπουκάλια, ξεβιδώνοντας το μπλε πλαστικό τμήμα στην αντίθετη κατεύθυνση των βελόνων ενός ρολογιού. Μην αγγίζετε το άκρο του πλαστικού προσαρμογής που συνδέεται με το μπουκάλι Veyvondi που περιέχει το διαλυμένο προϊόν. Τοποθετήστε το μπουκάλι Veyvondi σε μια επίπεδη επιφάνεια εργασίας. Απορρίψτε το κενό μπουκάλι διαλύτη.
 |
8) Πυροβολήστε αέρα στην αποστειρωμένη πλαστική σύριγγα για μία κενή χρήση τραβώντας το έμβολο. Η ποσότητα του αέρα πρέπει να είναι ίση με την ποσότητα του ανασυσταθείσα Veyvondi που θα αφαιρεθεί από το μπουκάλι.
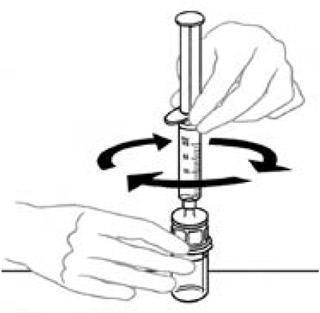 |
9) Αφήνοντας τη φιάλη Veyvondi (που περιέχει το ανασυσταθέν προϊόν) τοποθετημένο στην επίπεδη επιφάνεια εργασίας, συνδέοντας τη σύριγγα με τη διαφανή πλαστική τοποθέτηση και βιδώνοντας τη σύριγγα προς την κατεύθυνση των βελόνων ενός ρολογιού. | Με το ένα χέρι και το άλλο χέρι, εισάγετε τη συνολική ποσότητα αέρα της σύριγγας στη φιάλη.
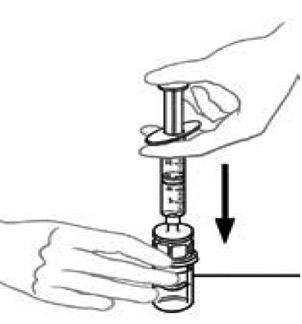 |
10) Tenir le flacon d'une main et de l'autre main, injecter la quantité totale d'air de la seringue dans le flacon.
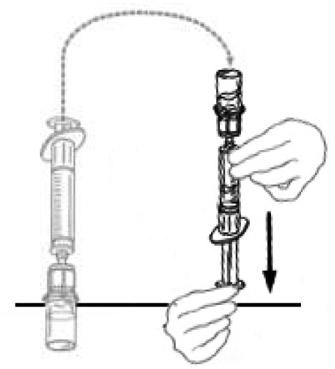 |
11) Γυρίστε τη σύριγγα που συνδέεται με το μπουκάλι expondvondi έτσι ώστε το μπουκάλι να είναι πάνω από τη σύριγγα. Διατηρήστε το έμβολο μέσα στη σύριγγα, πιέζοντας το. Πάρτε Veyvondi στη σύριγγα τραβώντας αργά το έμβολο.
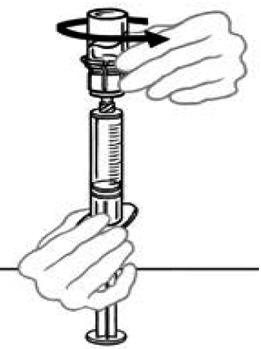 |
12) Η λύση δεν πρέπει να απομακρυνθεί από τη φιάλη στη σύριγγα και στη συνέχεια να επανεμφανιστεί στη φιάλη, αυτό θα μπορούσε να βλάψει το φάρμακο. Μόλις είστε έτοιμοι για την έγχυση, αποσυνδέστε τη σύριγγα, ξεβιδώνοντας την προς την αντίθετη κατεύθυνση των βελόνων ενός ρολογιού. Επιθεωρήστε οπτικά τη σύριγγα για να εξασφαλίσετε την απουσία σωματιδίων. Η λύση πρέπει να είναι καθαρή και άχρωμη. Εάν παρατηρούνται νιφάδες ή σωματίδια στο διάλυμα, μην το χρησιμοποιείτε και προειδοποιείτε τον γιατρό.
13) Σε περίπτωση ανάγκης περισσότερων από ένα μπουκάλι Veyvondi για την ανακατασκευή της δόσης:14) Τα περιεχόμενα δύο μπουκαλιών μπορούν να ληφθούν από μία σύριγγα.
Σημείωση: Κατά τη διάρκεια της έγχυσης αέρα σε ένα δεύτερο μπουκάλι Veyvondi που πρέπει να μεταφερθεί σε σύριγγα, τοποθετήστε το μπουκάλι και τη συνδεδεμένη σύριγγα έτσι ώστε το μπουκάλι να είναι πάνω. | Διοίκηση:
Instructions d'administration :
Επιθεωρήστε το διάλυμα που παρασκευάζεται στη σύριγγα για να επαληθεύσει την απουσία σωματιδίων και την αλλοίωση του χρώματος πριν από τη χορήγηση (το διάλυμα πρέπει να είναι σαφές, άχρωμο και απαλλαγμένο από σωματίδια). Δεν είναι ασυνήθιστο για κάποιες νιφάδες ή σωματίδια ανάρτησης να παραμείνουν στο μπουκάλι προϊόντος μετά την ανασύσταση. Το φίλτρο που περιλαμβάνεται στη συσκευή Mix2Vial εξαλείφει πλήρως αυτά τα σωματίδια. Η διήθηση δεν επηρεάζει τους υπολογισμούς της δόσης που πρέπει να χορηγηθούν. Η λύση που υπάρχει στη σύριγγα δεν πρέπει να χρησιμοποιείται εάν είναι προβληματισμένη ή περιέχει νιφάδες ή σωματίδια μετά από διήθηση.
= Μεγάλους όγκους Veyvondi είναι απαραίτητοι, είναι δυνατό να ομαδοποιηθούν δύο μπουκάλια Veyvondi. Το περιεχόμενο κάθε ανασυσταθμένου προϊόντος του Veyvondi μπορεί να ληφθεί από μία σύριγγα. Ωστόσο, σε αυτές τις περιπτώσεις, η αρχικά ανασυγκροτημένη λύση του Veyvondi δεν πρέπει να αραιωθεί.
Διαχειριστείτε σθεναρά τη λύση με ενδοφλέβια διαδρομή ( δοσολογία CF και τρόπος χορήγησης), χωρίς να υπερβαίνει τη ροή 4 mL/min. | Τοποθετήστε τη βελόνα, τη σύριγγα και το Veyvondi και τα κενά μπουκάλια σε έναν συλλέκτη άκαμπτων αιχμηρών αντικειμένων έτσι ώστε να εξαλειφθούν κατάλληλα. Μην ρίχνετε αυτά τα υλικά σε ένα συνηθισμένο σκουπίδια απόβλητα οικιακής χρήσης.
Ne pas replacer le capuchon sur l'aiguille. Placer l'aiguille, la seringue et les flacons de Veyvondi et de solvant vides dans un collecteur d'objets tranchants rigide pour qu'ils soient éliminés de manière appropriée. Ne pas jeter ces matériaux dans une poubelle d'ordures ménagères ordinaire.
Οποιοδήποτε αχρησιμοποίητο φάρμακο ή απόβλητα πρέπει να εξαλειφθεί σύμφωνα με τους κανονισμούς που ισχύουν.
= συνταγή/απελευθέρωση/υποστήριξη |
| = Νοσοκομείο. | |
| AMM | ΕΕ/1/18/1298/001; CIP 3400955057437 (15.11.2023) FL 650 UI. |
| ΕΕ/1/18/1298/002; CIP 34009550574444 (15.11.2023) FL 1300 UI. | |
| Συλλέξτε. |
| Παραγγείλετε τις διακυμάνσεις και τη λωρίδα (HT) από την UCD: | |
| UCD 3400894403210 (FL 650 UI): 611.171 ευρώ. | |
| UCD 3400894403159 (FL 1300 IU): 1222.341 ευρώ. | |
| Καταχωρήθηκε στον κατάλογο αποκατάστασης με υποστήριξη 100% και στον κατάλογο των ειδικότητες που υποστηρίζονται επιπλέον του GHS. | Η AMM: | |
Titulaire de l'AMM : Baxalta Innovations GmbH, Industri είναι 67, 1221 Vienne, Αυστρία.