| | par dose* |
Polyoside de Neisseria meningitidis== of group A (1 )|| 752
| 5 µg |
Polyoside of Neisseria meningitidis= of group C (1 )|| 762
| 5 µg |
Polyoside de Neisseria meningitidis de groupe W135(1)
| 5 µg |
Polyoside de Neisseria meningitidis de groupe Y(1)
| 5 µg |
Excipients : Poudre : saccharose, trométamol.
Solvant : chlorure de sodium, eau ppi.
*
Après reconstitution, pour 1 dose de 0,5 ml.
(1)
Συζευγμένο με την ανατοξίνη του τετάνου ως διανυσματική πρωτεΐνη: 44 μg/δόση.
Το Nimenrix υποδεικνύεται στην ενεργή ανοσοποίηση των ατόμων από 6 εβδομάδες έναντι επεμβατικών μηνιγγιτιδοκοκκικών ασθενειών λόγω
Neisseria meningitidis des groupes A, C, W
135 και Y.
Δοσολογία και τρόπος διαχείρισης |
Σύνδεση για πρόσβαση σε αυτό το περιεχόμενο
Προειδοποιήσεις και προφυλάξεις για χρήση |
-
Τοποδυτικότητα:
- Για να βελτιωθεί η ανιχνευσιμότητα των βιολογικών φαρμάκων, πρέπει να καταγραφεί σαφώς ο αριθμός και ο αριθμός παρτίδας του διαχειριζόμενου προϊόντος.
Το Nimenrix δεν πρέπει σε καμία περίπτωση να χορηγείται από ενδοαγγειακές, ενδοδερμικές ή ενδοαγγειακές ή υποδόριες.
Σύμφωνα με τις καλές κλινικές πρακτικές, ο εμβολιασμός πρέπει να προηγείται από την αξιολόγηση του ιατρικού ιστορικού (ιδίως των προηγούμενων εμβολιασμών και της πιθανής εμφάνισης των ανεπιθύμητων ενεργειών) και της κλινικής εξέτασης.
Συνιστάται να έχετε πάντα την κατάλληλη ιατρική περίθαλψη και να παρακολουθείτε, στη σπάνια αναφυλακτική περίπτωση σύμφωνα με τη χορήγηση του εμβολίου.
-
Διαρροή ασθένεια:
- Ο εμβολιασμός από το Nimenrix πρέπει να αναβληθεί σε άτομα που πάσχουν από ασθένεια οξέος πυρετού. Η παρουσία καλοήθης μόλυνσης, όπως ένα κρύο, δεν πρέπει να οδηγεί σε αναβολή εμβολιασμού.
-
Συγκοπή:
- Συγκοπή (λιποθυμία) μπορεί να συμβεί μετά από οποιοδήποτε εμβολιασμό ή ακόμα και πριν, ιδίως σε εφήβους, ως ψυχογενή αντίδραση στην ένεση με βελόνα. Αυτό μπορεί να συνοδεύεται από διάφορα νευρολογικά συμπτώματα, όπως μια διαταραχή μεταβατικής όρασης, παραισθησία και τονωτικές κλονικές κινήσεις των άκρων κατά τη διάρκεια της φάσης ανάκτησης. Είναι σημαντικό να τεθούν σε εφαρμογή μέτρα προκειμένου να αποφευχθούν τραυματισμοί σε περίπτωση λιποθυμίας.
-
Διαταραχές θρομβοκυτταροπενίας και πήξης:
- Το Nimenrix πρέπει να χορηγείται με προσοχή σε άτομα που παρουσιάζουν θρομβοκυτταροπενία ή διαταραχή πήξης λόγω του κινδύνου αιμορραγίας που μπορεί να εμφανιστεί μετά το εμβόλιο ενδομυϊκής χορήγησης σε αυτά τα άτομα.
-
Ανοσοανεπάρκεια:
- Une réponse immunitaire adéquate peut ne pas être obtenue chez les patients recevant un traitement immunosuppresseur ou chez les patients immunodéprimés.
- Les personnes présentant des déficits familiaux en complément (par exemple, des déficits en C5 ou C3) et les personnes recevant des traitements inhibant l'activation terminale du complément (par exemple, l'éculizumab) ont un risque accru de maladie invasive due à Meningitis Neisseria των οροομάδων A, C, W 135 και Υ, ακόμη και αν αναπτύξουν εμβολιασμό αντιβώδους με Nimenrix.
-
Προστασία από μηνιγγιτιδοκοκκικές λοιμώξεις:
- Το Nimenrix θα προστατεύσει μόνο από Meningitis Neisseria των ομάδων a, c, w 135 και Y. Το εμβόλιο δεν θα προστατεύσει από άλλες ομάδες Neisseria meningitidis.
- Une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
-
-
= Επίδραση προηγούμενων ανοσοποιήσεων με πολυοσειδικό μηνιγγιτιδοκοκκικό εμβόλιο:
- Πολυοσιδικό μηνιγγιτιδοκοκκικό εμβόλιο που δεν συζευγνύεται και εμβολιάστηκε από Nimenrix 30 έως 42 μήνες αργότερα, οι οποίοι δεν έχουν ληφθεί ληφθέντες ελλειπόμενους τίτλους αντισωμάτων (MGT) (MGT). CF Φαρμακοδυναμικήcf Pharmacodynamie). Η κλινική σημασία αυτής της παρατήρησης είναι άγνωστη.
-
-
Επίδραση των αντισωμάτων αντισωμάτων αντιτοξίνης Tetanic Pre-Vaccine:
- Η ανοχή και η ανοσογονικότητα του Nimenrix αξιολογήθηκαν όταν χορηγήθηκε διαδοχικά ή συγχορηγήθηκε με εμβόλιο που περιείχε ανατοξίνες διφυγίου και τετάνου, ακυτταρική αγάπη, αδρανοποιημένη πολιομυελίτιδα (τύπου 1, 2 και 3), επιφανειακή αντιγόνο της ηπατίτιδας Β και | 935 Haemophilus influenzae Φωσφορικό τύπου Β σε συνδυασμό (DTCAP-HEPB/HIB) κατά τη διάρκεια του δεύτερου έτους της ζωής. Η χορήγηση του Nimenrix ένα μήνα μετά το εμβόλιο DTCAP-HEPB/HIB οδήγησε σε MGT RSBAS έναντι των ομάδων Α, C και W 135 χαμηλότερο σε σύγκριση με τη συν-διοίκηση ( CF αλληλεπιδράσεις). La pertinence clinique de cette observation est inconnue.
-
-
Η ανοσοαπόκριση σε βρέφη ηλικίας 6 μηνών έως λιγότερο από 12 μήνες:
- Μια ενιαία δόση που χορηγείται σε 6 μήνες έχει συσχετιστεί με χαμηλότερους τίτλους της δοκιμής δραστικότητας ορού βακτηριδιδίου χρησιμοποιώντας ανθρώπινο συμπλήρωμα (HSBA) για ομάδες W σε σύγκριση με τρεις δόσεις που χορηγήθηκαν σε 2, 4 και 6 μήνες (|| 954 et Y, comparativement à trois doses administrées à 2, 4 et 6 mois (cf Pharmacodynamie). Η κλινική σημασία αυτής της παρατήρησης είναι άγνωστη. Εάν ένα βρέφος ηλικίας 6 μηνών έως λιγότερο από 12 μήνες υποτίθεται ότι εκτίθεται σε συγκεκριμένο κίνδυνο διηθητικής μηνιγγκικής νόσου λόγω έκθεσης σε ομάδες w 135 και/ή y, μπορεί να προβλεφθεί να χορηγηθεί μια δεύτερη δόση primovaccination του Nimenrix μετά από ένα διάστημα 2 μηνών.
-
-
Ανοσολογικές αντιδράσεις σε μικρά παιδιά ηλικίας 12 έως 14 μηνών:
- Les enfants en bas âge âgés de 12 à 14 mois présentaient des titres rSBA similaires aux groupes A, C, W 135 και ένα μήνα μετά από μια δόση Nimenrix μήνα μετά από δύο δόσεις Nimenrix που χορηγήθηκε δύο μήνες μεταξύ τους.
- Μία δόση συσχετίστηκε με χαμηλότερους τίτλους HSBA για ομάδες W 135 και y σε σύγκριση με τις δύο δόσεις που χορηγήθηκαν δύο μήνες. Απαντήσεις παρόμοιες με τις ομάδες Α και C παρατηρήθηκαν μετά από μία ή δύο δόσεις ( Φαρμακοδυναμική). Η κλινική σημασία αυτής της παρατήρησης είναι άγνωστη. Εάν ένα μικρό παιδί θεωρείται ιδιαίτερα σε κίνδυνο να αναπτύξει μια επεμβατική μηνιγγκική λοίμωξη μετά από έκθεση σε ομάδες W 135 και/ή y, μπορεί να προβλεφθεί για τη χορήγηση μιας δεύτερης δόσης Nimenrix μετά από ένα διάστημα δύο μηνών. Όσον αφορά τη μείωση των αντισωμάτων που κατευθύνονται κατά των ομάδων Α και C μετά από μια πρώτη δόση Nimenrix σε παιδιά ηλικίας 12 έως 23 μηνών, βλέπε εμμονή των τίτλων σε βακτηριοκτόνο αντίσωμα ορού.
-
= Επιστροφή των τίτλων σε βακτηριίδια αντισώματος ορού: | Nimenrix Υπάρχει μείωση των τίτλων σε βακτηριοκτόνα αντισώματα ορού έναντι της ομάδας Α όταν η δοκιμή χρησιμοποίησε HSBA (|| 992
- Suite à l'administration de Nimenrix il y a une décroissance des titres en anticorps sériques bactéricides contre le groupe A quand le test a utilisé du hSBA (cf Pharmacodynamie). Η κλινική σημασία αυτής της παρατήρησης είναι άγνωστη. Ωστόσο, εάν ένα υποκείμενο θεωρείται ιδιαίτερα κίνδυνο έκθεσης στην ομάδα Α και έχει λάβει δόση Nimenrix περίπου περισσότερο από ένα χρόνο νωρίτερα, μπορεί να προβλεφθεί η χορήγηση μιας δόσης ανάκλησης.
- Η μείωση των τίτλων αντισωμάτων έχει παρατηρηθεί με την πάροδο του χρόνου για τις ομάδες Α, C, W135 et Y. La pertinence clinique de cette observation est inconnue. Une dose de rappel pourra être envisagée chez les sujets vaccinés en bas âge et restant exposés à un risque élevé de maladies méningococciques dues aux groupes A, C, W 135 ή y (|| 1000 cf Pharmacodynamie). Αντι -προδιαγραφιστικά αντισώματα:
-
Effet de Nimenrix sur les concentrations en anticorps antitétaniques :
- Αν και παρατηρήθηκε αύξηση των τετανικών συγκεντρώσεων αντισωμάτων αντι -αποθήκευσης (TT) μετά τον εμβολιασμό με Nimenrix, το Nimenrix δεν αντικαθιστά τον εμβολιασμό κατά του Skate.
- = Η χορήγηση του Nimenrix ταυτόχρονα ή 1 μήνα πριν από ένα εμβόλιο που περιέχει TT κατά τη διάρκεια του δεύτερου έτους της ζωής δεν μεταβάλλει την ανταπόκριση στο TT και δεν επηρεάζει σημαντικά την ανοχή. Δεν υπάρχουν διαθέσιμα δεδομένα σε θέματα άνω των 2 ετών.
-
Περιεχόμενο νατρίου:
- Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c'est-à-dire qu'il est essentiellement « sans sodium ».
Γονιμότητα/εγκυμοσύνη/θηλασμός |
Εγκυμοσύνη:
Η εμπειρία της χρήσης του Nimenrix σε έγκυες γυναίκες είναι περιορισμένη.
Οι μελέτες που διεξάγονται σε ζώα δεν έχουν επισημάνει άμεσες ή έμμεσες επιβλαβείς επιδράσεις στην κύηση, την εμβρυϊκή/εμβρυϊκή ανάπτυξη, ( CF προκλινική ασφάλεια).
Το Nimenrix πρέπει να χρησιμοποιείται κατά τη διάρκεια της εγκυμοσύνης μόνο όταν αυτό είναι σαφώς απαραίτητο και τα πιθανά πλεονεκτήματα επικρατούν τους πιθανούς κινδύνους για το έμβρυο.
Θηλασμός:
Δεν γνωρίζουμε αν το Nimenrix εκκρίνεται στο μητρικό γάλα.
Το Nimenrix πρέπει να χρησιμοποιείται κατά τη διάρκεια του θηλασμού μόνο εάν τα πιθανά πλεονεκτήματα επικρατούν για πιθανούς κινδύνους.
Γονιμότητα:
= Οι μελέτες που πραγματοποιήθηκαν σε ζώα έμμεσα στη γονιμότητα.
Οδήγηση και χρήση μηχανών |
Δεν έχει διεξαχθεί μελέτη σχετικά με τις επιδράσεις του Nimenrix στην ικανότητα οδήγησης οχημάτων και χρήσης μηχανών.
Ωστόσο, ορισμένα αποτελέσματα που αναφέρονται στο τμήμα
Untoirable Effects Χρήση μηχανών.
Δεν έχει αναφερθεί περίπτωση υπερβολικής δόσης. | Αυτό το περιεχόμενο
Τα μη κλινικά δεδομένα από συμβατικές μελέτες τοπικής ανοχής, οξεία τοξικότητα, τοξικολογία στην επαναλαμβανόμενη χορήγηση και λειτουργίες αναπαραγωγής/ανάπτυξης και γονιμότητας δεν έχουν αποκαλύψει κανένα ιδιαίτερο κίνδυνο για τον άνθρωπο. | Συμβατότητα, αυτό το φάρμακο δεν πρέπει να αναμειγνύεται με άλλα φάρμακα.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
-
Χρόνος συντήρησης:
- 4 χρόνια.
- Η μη ανοιχτή φιάλη είναι σταθερή για 72 ώρες όταν διατηρείται σε θερμοκρασίες μεταξύ 0 ° C και 2 ° C ή μεταξύ 8 ° C στο τέλος αυτής της περιόδου, το Nimenrix πρέπει να χρησιμοποιηθεί ή να πεταχτεί. Αυτά τα δεδομένα αποσκοπούν στην καθοδήγηση επαγγελματιών υγείας σε περίπτωση προσωρινών μεταβολών θερμοκρασίας. Μην παγώσετε. Για να κρατήσετε την αρχική εξωτερική συσκευασία, προστατευμένη από το φως.
A conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler. A conserver dans l'emballage extérieur d'origine, à l'abri de la lumière.
-
Μετά την ανασύσταση:
- Μετά την ανασύσταση, το εμβόλιο πρέπει να χρησιμοποιείται γρήγορα. Αν και δεν συνιστάται να περιμένετε, η σταθερότητα έχει αποδειχθεί για 8 ώρες στους 30 ° C μετά την ανασυγκρότηση. Εάν το εμβόλιο δεν χρησιμοποιείται εντός 8 ωρών, μην το χορηγήσετε.
Μέθοδος χειραγώγησης/εξάλειψης |
-
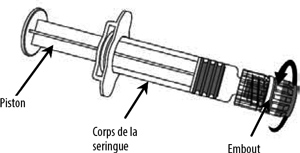
Οδηγίες για την ανασυγκρότηση του εμβολίου με τον διαλύτη που παρουσιάζεται ως προ -εκχυλισμένη σύριγγα:
- Το Nimenrix πρέπει να ανακατασκευαστεί προσθέτοντας ολόκληρο το περιεχόμενο της σκόνης σύριγγας που έχει εκχρωματιστεί.
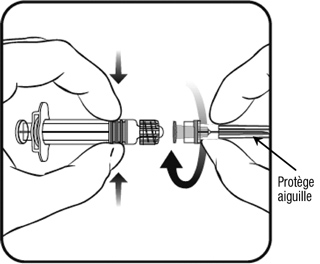
- Για να διορθώσετε τη βελόνα στη σύριγγα, ανατρέξτε στην παρακάτω εικόνα. Ωστόσο, η σύριγγα που παρέχεται με Nimenrix μπορεί να είναι ελαφρώς διαφορετική (χωρίς το βήμα βίδας) της σύριγγας που περιγράφεται στην απεικόνιση. Σε αυτή την περίπτωση, η βελόνα μπορεί να σταθεροποιηθεί χωρίς βίδα.
-
- κρατώντας το Σώμα της σύριγγας με ένα χέρι (αποφεύγοντας τη συγκράτηση του εμβόλου), ξεβιδώστε την προστατευτική άκρη της σύριγγας γυρίζοντας την προς την αντίθετη κατεύθυνση των βελόνων ενός ρολογιού. | Η βελόνα προς την κατεύθυνση των βελόνων ενός ρολογιού στη σύριγγα μέχρι να νιώσετε ένα μπλοκάρισμα (δείτε την εικόνα).
- Pour fixer l'aiguille sur la seringue, visser l'aiguille dans le sens des aiguilles d'une montre sur la seringue jusqu'à sentir un blocage (voir l'illustration).
- Αφαιρέστε τον προστατευτικό Aiguille, το οποίο μερικές φορές μπορεί να είναι λίγο δύσκολο.
- Προσθέστε τον διαλύτη στη σκόνη. Μετά την προσθήκη του διαλύτη στη σκόνη, το μείγμα πρέπει να είναι ανήσυχο έως ότου η σκόνη διαλυθεί πλήρως στον διαλύτη.
Le vaccin reconstitué est une solution transparente et incolore.
Το ανασυσταθισμένο εμβόλιο πρέπει να επιθεωρείται οπτικά για να ελέγξει την απουσία οποιουδήποτε ξένου σωματιδίου ή/και οποιαδήποτε αλλαγή στη φυσική του εμφάνιση, πριν από τη χορήγηση. Σε το ένα ή το άλλο από αυτές τις περιπτώσεις, ρίξτε το εμβόλιο.
Μετά την ανασυγκρότηση, το εμβόλιο πρέπει να χρησιμοποιείται γρήγορα.
Μια νέα βελόνα πρέπει να χρησιμοποιηθεί για τη χορήγηση του εμβολίου.
Οποιοδήποτε μη χρησιμοποιούμενο ή απόβλητο προϊόν πρέπει να εξαλειφθεί σύμφωνα με τους κανονισμούς που ισχύουν. | Φόρτωση
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
Λίστα I
| AMM | ΕΕ/1/12/767/003; CIP 3400922253930 (2012, RCP Rev 24.10.2024). |
| | |
| Τιμή: | 39,22 ευρώ (1 μπουκάλι +1 προ -εκχυλισμένη σύριγγα +2 βελόνες). |
| Περιεχόμενο SEC SOC 65% και εξουσιοδοτημένη συλλογή στην ένδειξη "Ενεργός ανοσοποίηση ατόμων από την ηλικία των 6 εβδομάδων έναντι των διηθητικών μηνιγγιτιδοκοκκικών ασθενειών λόγω των Neisseria C, W-135 και Y, σύμφωνα με τις συστάσεις που ισχύουν από τη χρονολόγηση από τις 7 Μαρτίου 2024 και 27 Ιουνίου 2024". |
Outfit of the AMM: Pfizer Europe Ma Eeig, 17, Boulevard de la Plaine, 1050 Βρυξέλλες, Βέλγιο. Βλέπε 1244
Exploitant :