Veuillez saisir au moins 3 caractères pour votre recherche.
- φάρμακα
- BoostrixTetra
- Boostrixtra Susp Ir Ser Préremplie
Περίληψη
= Ανατοξίνη του Bordetella pertassis
= Bordetella pertassis νηματοειδή αιμοσυγκολλητίνη
Pertactin de Bordetella pertassis
= Απενεργοποιημένος ιός πολιομυελίτιδας Τύπος 1
Απενεργοποιημένος πολιτικός ιός τύπου 2
Απενεργοποιημένος ιός πολιομυελικού τύπου 3
EEN sans dose seuil : Φινυλαλανίνη,= para-aminobenzoic
CIP: 3400936773875
Μέθοδοι διατήρησης: Πριν από το άνοιγμα: 2 ° <8 ° για 36 μήνες (κρατήστε υπό το φως του φωτός, κρατήστε τη συσκευασία του, ψυγείο, μην παγώσετε)
Μετά το άνοιγμα: <21 ° DUR 8 ώρες
Μορφές και παρουσιάσεις |
Σύνθεση |
| με δόση (0,5 mL) | ||
| = Διφωτό της ανθεξίνης (1) | ≥ 2 UI(3) (2,5 Lf) | |
| = Tetanique (1) | ≥ 20 UI (3) (5 LF) | |
| Antigènes de Bordetella pertussis : | ||
|
-Pertusic Anatoxine (1) | 8 μg | |
|
-νήμα αιμοσυγκολλητίνης (1) | 8 μg | |
|
-Σχετική (1) | 2,5 μg | |
| Απενεργοποιημένο: | ||
|
-Τύπος 1 (στέλεχος Mahoney) (2) | 40 UD (4) | |
|
- MEF-1) || 843 (2) | 8 UD (4) | |
|
-Τύπος 3 (στέλεχος Saukett) || 852 (2) | 32 UD (4) | |
= Excipient με περιβόητο αποτέλεσμα: Το εμβόλιο περιέχει λιγότερο από 0,07 νανογράμμα παρα-αμινοβενζοϊκού οξέος ανά δόση και 0,0298 μικρογραμμάρια με δόση ( CF προειδοποιήσεις και προφυλάξεις για χρήση || 866 ).
Το εμβόλιο μπορεί να περιέχει ίχνη φορμαλδεΰδης, νεομυκίνης και πολυμυξίνης που έχουν χρησιμοποιηθεί κατά τη διάρκεια της διαδικασίας κατασκευής (|| 869 cf Contre-indications).
(1)= Προσροφήστε στο ενυδατωμένο οξείδιο του αργιλίου [AL (OH) 3] (Σύνολο: 0,3 mg al 3+) και φωσφορικό αργίλιο [apo 4] (Σύνολο: Σύνολο: Σύνολο: 0,2 mg al 3+ || 881 ).Ενδείξεις |
Δοσολογία και τρόπος διαχείρισης |
Συνδέστε τον εαυτό σας pour accéder à ce contenu
Αντενδείξεις |
Σύνδεση για πρόσβαση σε αυτό το περιεχόμενο
Προειδοποιήσεις και προφυλάξεις για χρήση |
Ο εμβολιασμός πρέπει να προηγείται από την αναζήτηση ιατρικού ιστορικού (ιδίως για προηγούμενους εμβολιασμούς και ανεπιθύμητες ενέργειες που ήταν σε θέση να προκύψουν).
Εάν η εμφάνιση ενός από τα ακόλουθα συμβάντα συνδέεται χρονολογικά με τη χορήγηση εμβολίου που περιέχει την παπαρούνα για τη χορήγηση άλλων δόσεων εμβολίων που περιέχουν το σθένος διατροφής πρέπει να αξιολογηθούν προσεκτικά:Μπορεί να υπάρχουν ορισμένες περιστάσεις, ιδίως σε περίπτωση υψηλής επίπτωσης εμβολιασμού που υπερβαίνει τους πιθανούς κινδύνους.
Όσον αφορά κάθε εμβολιασμό, πρέπει να αξιολογηθεί ο λόγος παροχής/κινδύνου για την εκτέλεση εμβολιασμού από το Boostrixtra ή την απόσπασή του σε ένα παιδί που πάσχει από σοβαρή νευρολογική ασθένεια, είτε νέα είτε εξελικτική, πρέπει να αξιολογείται με προσοχή.
Όπως συμβαίνει με όλα τα ενέσιμα εμβόλια, συνιστάται να έχετε πάντοτε την κατάλληλη ιατρική περίθαλψη και να εξασφαλίσετε την επιτήρηση για τη σπάνια περίπτωση όπου θα προέκυπτε μια αναφυλακτική αντίδραση σύμφωνα με τη χορήγηση του εμβολίου.
Το BoostrixTetra πρέπει να χορηγείται με προσοχή σε άτομα που παρουσιάζουν θρομβοκυτοπενία ( CF αντενδείξεις) ή διαταραχή πήξης λόγω του κινδύνου αιμορραγίας ενδομυϊκής. Με την επιφύλαξη της συμμόρφωσης με τις επίσημες συστάσεις, το εμβόλιο μπορεί να χορηγηθεί σε αυτά τα υποδόρια άτομα. Για αυτά τα δύο μονοπάτια, η σταθερή πίεση πρέπει να ασκείται στο σημείο έγχυσης (χωρίς τρίψιμο) για τουλάχιστον 2 λεπτά.
Boostrixtetra ne doit en aucun cas être administré par voie intravasculaire.
Προσωπικού ιστορικού πυρετών σπασμών, οικογενειακού ιστορικού σπασμών ή οικογενειακού ιστορικού ανεπιθύμητων εκδηλώσεων μετά από εμβολιασμό Diphtheria-Totanos-Coqueluche (DTCA) δεν αποτελούν αντενδείξεις.
Η μόλυνση από τον ιό της ανθρώπινης ανοσοανεπάρκειας (HIV) δεν θεωρείται αντένδειξη. Η αναμενόμενη ανοσοαπόκριση δεν μπορεί να ληφθεί μετά τον εμβολιασμό σε ανοσοκατασταλμένους ασθενείς.
Συγκοπή (λιποθυμία) μπορεί να εμφανιστεί μετά από οποιοδήποτε εμβολιασμό ή ακόμα και πριν, ιδίως σε εφήβους, ως ψυχογενή αντίδραση στην ένεση με βελόνα. Αυτό μπορεί να συνοδεύεται από διάφορα νευρολογικά σημάδια, όπως μια παροδική διαταραχή της όρασης, της παραισθησίας και των τονονοκρονικών κινήσεων των άκρων κατά τη διάρκεια της φάσης ανάκτησης. Είναι σημαντικό να τεθούν σε εφαρμογή μέτρα προκειμένου να αποφευχθούν τραυματισμοί σε περίπτωση λιποθυμίας.
Όσον αφορά όλα τα εμβόλια, μια προστατευτική ανοσοαπόκριση δεν μπορεί να ληφθεί σε όλους τους εμβολιασμένους ανθρώπους.
αλληλεπιδράσεις |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
Γονιμότητα/εγκυμοσύνη/θηλασμός |
Το Boostrixtera μπορεί να χρησιμοποιηθεί κατά το δεύτερο ή το τρίτο τρίμηνο της εγκυμοσύνης σύμφωνα με τις επίσημες συστάσεις. | PEK σε βρέφη που γεννήθηκαν από γυναίκες που εμβολιάστηκαν κατά τη διάρκεια της εγκυμοσύνης, βλ. Τμήμα
Pour les données relatives à la prévention de la coqueluche chez les nourrissons nés de femmes vaccinées pendant la grossesse, voir rubrique Φαρμακοδυναμική.
Τα δεδομένα ασφαλείας από μια ελεγχόμενη και τυχαιοποιημένη κλινική μελέτη (341 συμμετέχοντες) και μια προοπτική μελέτη παρατήρησης (793 συμμετέχοντες), στην οποία η Boostrix Diphteric-TeTanic-Coquercheux de Boostrixtetra) διοικείται σε εγκυμοσύνες κατά τη διάρκεια του τρίτου τριμήνου της εγκυμοσύνης, δεν έδειξαν κανέναν συμβάντα για το εμβολιασμό για το GETERACE ή το Νεία του Νευτών. | Η εγκυμοσύνη δεν είναι διαθέσιμη.
Des données de sécurité d'études cliniques prospectives sur l'utilisation de Boostrixtetra ou de Boostrix pendant le premier et le deuxième trimestre de grossesse ne sont pas disponibles.
Τα δεδομένα παθητικής παρακολούθησης των εγκύων γυναικών, έχοντας λάβει είτε το Boostrix είτε το Boostrixtra (εμβόλιο DTCAP) κατά τη διάρκεια 2 E ή 3 E= ή η υγεία του εμβρύου/νεογέννητου.
Όπως και με άλλα αδρανοποιημένα εμβόλια, δεν αναμένεται ότι ο εμβολιασμός με το boostrixtra είναι επιβλαβής για το έμβρυο ανεξάρτητα από το τρίμηνο της εγκυμοσύνης. Οι μελέτες που διεξήχθησαν σε ζώα δεν έχουν επισημάνει μια άμεση ή έμμεση επιβλαβή επίδραση στην κύηση, την εμβρυϊκή ή την εμβρυϊκή ανάπτυξη, τον τοκετό ή τη μετα-εθνική ανάπτυξη ( CF προκλινική ασφάλεια).
Η επίδραση του Boostrixtra που αξιολογείται. Ωστόσο, καθώς το boostrixtera περιέχει ανατοξίνες και αδρανοποιημένα αντιγόνα, δεν πρέπει να αναμένεται κανένας κίνδυνος για θηλασμό. Τα κέρδη σε σύγκριση με τον κίνδυνο χορήγησης Boostrixtra με γυναίκες που θηλάζουν πρέπει να αξιολογούνται από επαγγελματίες υγείας.
Γονιμότητα:Aucune donnée d'études cliniques prospectives chez l'homme n'est disponible. Les études conduites chez l'animal n'ont pas mis en évidence d'effet délétère direct ou indirect sur la fertilité des femelles ( CF προκλινική ασφάλεια).
Οδήγηση και χρήση μηχανών |
EFFETS INDÉSIRABLES |
Σύνδεση για πρόσβαση σε αυτό το περιεχόμενο
Υπερδρύση |
Οι περιπτώσεις υπερβολικής δόσης αναφέρθηκαν κατά τη διάρκεια της παρακολούθησης μετά την εμπιστοσύνη. Τα ανεπιθύμητα αποτελέσματα μετά από υπερβολική δόση, όταν αναφέρθηκαν, ήταν παρόμοια με εκείνα που αναφέρθηκαν με κανονική χορήγηση του εμβολίου.
Φαρμακοδυναμική |
Σύνδεση για πρόσβαση σε αυτό το περιεχόμενο
Φαρμακοκινητική |
Σύνδεση πρόσβαση σε αυτό το περιεχόμενο pour accéder à ce contenu
Προκλινική ασφάλεια |
INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, ce vaccin ne doit pas être mélangé avec d'autres médicaments.
Έτοιμες μεθόδους |
Διάρκεια ανάγνωσης: 3 χρόνια.
A conserver dans l'emballage extérieur d'origine, à l'abri de la lumière.
για να κρατήσετε στο ψυγείο (μεταξύ 2 ° C και 8 ° C). | Έξοδος ψυγείου, το εμβόλιο είναι σταθερό 8 ώρες στους 21 ° C πέρα από αυτή την περίοδο, ρίξτε το εμβόλιο. Αυτές οι πληροφορίες αποσκοπούν στην καθοδήγηση επαγγελματιών υγείας μόνο σε περίπτωση προσωρινής εκδρομής θερμοκρασίας.
Ne pas congeler.
Après la sortie du réfrigérateur, le vaccin est stable 8 heures à 21 °C. Au-delà de cette période, jeter le vaccin. Ces informations sont destinées à guider les professionnels de santé uniquement en cas d'excursion temporaire de la température.
Μέθοδοι μοντελοποίησης/εξάλειψης |
Πριν από τη χρήση, το εμβόλιο πρέπει να είναι σε θερμοκρασία δωματίου και πρέπει να είναι καλά αναστατωμένος προκειμένου να ληφθεί μια ομοιογενή λευκή ανάρτηση OPAL. Πριν από τη χορήγηση, το εμβόλιο πρέπει να επιθεωρείται οπτικά για να επισημανθεί οποιοδήποτε ξένο σωματίδιο ή/και αλλοίωση της φυσικής όψης. Σε το ένα ή το άλλο από αυτές τις περιπτώσεις, μην χορηγείτε το εμβόλιο.
Οδηγίες για τη χρήση της προ -εκχυλισμένης σύριγγας
 |
Κρατήστε τη σύριγγα από το σώμα της σύριγγας και όχι από το έμβολο.
= Ξεβιδώστε την προστατευτική άκρη της σύριγγας γυρίζοντας την προς την αντίθετη κατεύθυνση των βελόνων ενός ρολογιού. Η βελόνα, συνδέστε τη βάση της βελόνας στον προσαρμογέα κλειδώματος Luer και γυρίστε το ένα τέταρτο της στροφής δεξιόστροφα μέχρι να νιώσετε ένα μπλοκάρισμα.
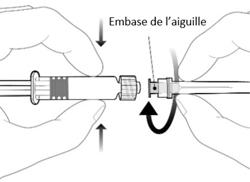 |
Pour fixer l'aiguille, connecter l'embase de l'aiguille sur l'adaptateur Luer Lock et tourner d'un quart de tour dans le sens des aiguilles d'une montre jusqu'à sentir un blocage.
Μην τραβάτε το έμβολο έξω από το σώμα της σύριγγας. Εάν συμβεί αυτό, μην χορηγήσετε το εμβόλιο.
Οδηγίες εξάλειψης
Οποιοδήποτε φάρμακο που δεν χρησιμοποιείται ή τα απόβλητα πρέπει να εξαλειφθεί σύμφωνα με τους κανονισμούς που ισχύουν.
= συνταγή/παράδοση/φροντίδα |
| AMM | 3400936773875 (2005, RCP Rev 14.09.2023). |
| Τιμή: | 21,69 ευρώ (Preremplie Syringe). | στο 65% και συλλέγονται εγκρίθηκαν στο πλαίσιο των συστάσεων εμβολίων που ισχύουν. |
| Remb Séc soc à 65 % et agréé Collect dans le cadre des recommandations vaccinales en vigueur. | |
Η έκδοση 2025 των συστάσεων ημερολογίου και εμβολίου δημοσιεύεται