Veuillez saisir au moins 3 caractères pour votre recherche.
Περίληψη
= Έκθεση του διαλύτη: νερό PPI
EEN sans dose seuil : Polysorbate 80
CIP: 3400930297797
Μέθοδοι διατήρησης: Πριν από το άνοιγμα: 2 ° <8 ° για 36 μήνες (κρατήστε στο καταφύγιο του φωτός, κρατήστε το ψυγείο, κρατήστε τη συσκευασία του, μην παγώσετε)
Μορφές και παρουσιάσεις |
Adzynma 500 UI σκόνη και solvant για ενέσιμη λύση
σκόνη (ψύξη, λευκό) και διαλύτης (κρύσταλλο και άχρωμο διάλυμα) για διάλυμα ένεσης. | 6.7-7.3 και ένα Osmoch που είναι τουλάχιστον 240 mosmol/kg.
La solution reconstituée a un pH de 6,7-7,3 et une osmolalité qui est d'au moins 240 mOsmol/kg.
Κάθε κουτί περιέχει:
Adzynma 1 500 IU Ενέσιμη
σκόνη (ψύξη-κάτω, λευκό) και διαλύτης (διάλυμα και άχρωμο διάλυμα) για διάλυμα ένεσης.
Η ανασυσταθείσα διάλυμα έχει ρΗ 6,7-7,3 και μια ωσμωτικότητα που είναι τουλάχιστον 240 mosmol/kg. | (Γυαλί τύπου Ι), εξοπλισμένο με καπάκι από καουτσούκ από βρύα
Chaque boîte contient :
Σύνθεση |
Adzynma 500 UI σκόνη και διαλύτης για διάλυμα ένεσης
Κάθε μπουκάλι σκόνης περιέχει ονομαστικά 500 διεθνείς μονάδες (UI) του ADAMTS13R*, που μετράται από την άποψη της εξουσίας. | Ανασύσταση με τα 5 mL που παρέχεται διαλύτης, η λύση έχει δραστηριότητα περίπου 100 IU/ml.
Après reconstitution avec les 5 mL de solvant fournis, la solution a une activité d'environ 100 UI/mL.
adzynma 1 500 ui σκόνη και solvant για ενέσιμη λύση
Κάθε μπουκάλι σκόνης περιέχει ονομαστικά 1.500 UI του Adamts13r*, που μετράται από την άποψη της ισχύος. | Υπό την προϋπόθεση ότι η λύση έχει δραστηριότητα περίπου 300 IU/ml.
Après reconstitution avec les 5 mL de solvant fournis, la solution a une activité d'environ 300 UI/mL.
* Το Adzynma είναι μια καθαρισμένη ανθρώπινη ανασυνδυασμένη πρωτεΐνη "μια αποσυμπίκενη και μια μεταλλοπρωτεΐνη με μοτίβα θρομβοσπονδίνης 13" (ADAMTS13R) που εκφράζονται σε κινεζικά κύτταρα των ωοθηκών (CHO) Recombinant (μίγμα ADAMTS13R q23 q23 q23 q23 aDANTATS13R R23.
σκόνη: Χλωριούχο νάτριο, Διένυδρο χλωριούχο ασβέστιο, Μννιτόλη L-η-ιστιδίνης, σακχαρόζη, πολυσορβικό 80 (Ε433).
Solvant: νερό για ενέσιμα παρασκευάσματα.
Ενδείξεις |
Το Adzynma υποδεικνύεται στην υποκατάστατη ενζυματική θεραπεία (TES) σε ενήλικες ασθενείς και παιδιά με θρομβωτική θρομβοκυτταροπενική συγγενή θρομβωτική (PTTC) λόγω ενός ελλείμματος ADAMTS13. 727
ADZYNMA peut être utilisé dans toutes les tranches d'âge.
Δοσολογία και τρόπος χορήγησης |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
αντενδείξεις |
Σύνδεση Για να αποκτήσετε πρόσβαση σε αυτά τα περιεχόμενα
Προειδοποιήσεις και προφυλάξεις για χρήση |
Τοποδυτικότητα
Για να βελτιωθεί η ανιχνευσιμότητα των βιολογικών φαρμάκων, πρέπει να καταγραφεί σαφώς το όνομα και ο αριθμός παρτίδας του χορηγούμενου προϊόντος.
αντιδράσεις υπερευαισθησίας
μπορεί να συμβεί μια αλλεργική υπερευαισθησία, συμπεριλαμβανομένων των αναφυλακτικών αντιδράσεων. Οι ασθενείς θα πρέπει να ενημερώνονται για τα πρώτα σημάδια των αντιδράσεων υπερευαισθησίας, ιδίως της ταχυκαρδίας, της θωρακικής καταπίεσης, της σφυρίχτρας της αναπνοής και/ή της οξείας αναπνευστικής δυσφορίας, της υπότασης, της γενικευμένης κνίδωσης, της κνησμού, της ρινόκερης-συνεπενδυτικής, του quincke edema, του leshargy, του nausea, του vomating, της προστασίας, της υπότασης. Σε περίπτωση σημείων και συμπτωμάτων σοβαρών αλλεργικών αντιδράσεων, η χορήγηση αυτού του φαρμάκου πρέπει να διακόπτεται αμέσως και να παρέχεται κατάλληλη φροντίδα υποστήριξης στον ασθενή.
Ανοσογονικότητα
Όσον αφορά όλες τις θεραπευτικές πρωτεΐνες, υπάρχει κίνδυνος ανοσογονικότητας. Οι ασθενείς μπορούν να αναπτύξουν αντισώματα που κατευθύνονται κατά του ADAMTS13R μετά από θεραπεία από την Adzynma, γεγονός που θα μπορούσε να οδηγήσει σε μείωση της ανταπόκρισης στο ADAMTS13R (βλ. Τμήμα Φαρμακοδυναμική). Εάν υπάρχει ύποπτη παρουσία τέτοιων αντισωμάτων και σημειώνεται έλλειψη αποτελεσματικότητας, πρέπει να ληφθούν υπόψη άλλες θεραπευτικές στρατηγικές.
Περιεχόμενο νατρίου
Ce médicament contient moins de 1 mmol (23 mg) de sodium par mL, c.-à-d. qu'il est essentiellement « sans sodium ».
αλληλεπιδράσεις |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
Γονιμότητα/εγκυμοσύνη/θηλασμός |
Εγκυμοσύνη
Δεν υπάρχουν περιορισμένα δεδομένα σχετικά με τη χρήση του Adzynma. Οι μελέτες που διεξήχθησαν σε ζώα δεν έχουν επισημάνει άμεσες ή έμμεσες επιβλαβείς επιδράσεις στην αναπαραγωγή (βλ. Ενότητα Προκλινική ασφάλεια). Η χρήση του Adzynma κατά τη διάρκεια της εγκυμοσύνης μπορεί να ληφθεί υπόψη μόνο μετά από μια ατομική ανάλυση των κινδύνων και των κερδών από τον συνταγογραφούμενο γιατρό πριν και κατά τη διάρκεια της θεραπείας.
Θηλασμός
Δεν υπάρχουν επαρκή δεδομένα σχετικά με την απέκκριση του ADAMTS13R στο μητρικό γάλα ή το ζώο, αλλά ενόψει του υψηλού μοριακού βάρους του, είναι απίθανο να εκκριθεί στη μητέρα του γάλακτος. Η απόφαση για τη διακοπή του θηλασμού ή της σύλληψης του Adzynma πρέπει να βασιστεί στη σημασία του φαρμάκου για τη μητέρα.
Γονιμότητα
Δεν έχουμε ανθρώπινα δεδομένα σχετικά με τις επιπτώσεις του ADAMTS13R στην αρσενική και τη γυναικεία γονιμότητα. Τα δεδομένα των ζώων δεν υποδεικνύουν άμεσες ή έμμεσες επιβλαβείς επιπτώσεις στη γονιμότητα των αρσενικών και των θηλυκών (βλ. Ενότητα Προκλινική ασφάλεια).
Οδήγηση και χρήση μηχανών |
Το ADAMTS13R μπορεί να έχει μικρή επιρροή στην ικανότητα να οδηγεί οχήματα και να χρησιμοποιεί μηχανές. Μπορεί να εμφανιστεί μια ακτινοβολία και υπνηλία μετά τη χορήγηση του Adzynma (βλ. Ενότητα Ανεπιθύμητες ενέργειες).
ανεπιθύμητα αποτελέσματα |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
ourdosage |
Dans les études cliniques, des doses uniques allant jusqu'à 160 UI/kg ont été utilisées, et leur profil de sécurité était généralement cohérent avec les résultats des études cliniques chez les patients atteints de PTTc.
Σε περίπτωση υπερδοσολογίας, λαμβάνοντας υπόψη τη φαρμακολογική δράση του ADAMTS13R, υπάρχει αυξημένος πιθανός κίνδυνος αιμορραγίας (βλ. Τμήμα Φαρμακοδυναμική).
Φαρμακοδυναμική |
Σύνδεση για πρόσβαση σε αυτό το περιεχόμενο
Φαρμακοκινητική |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
Προκλινική ασφάλεια |
Μη κλινικά δεδομένα που προκύπτουν από μελέτες φαρμακολογίας ασφαλείας, τοξικολογία στην ενιαία χορήγηση, τοξικότητα στις λειτουργίες αναπαραγωγής και ανάπτυξης τοπικών και ανοσογονικότητας, δεν έχουν αποκαλύψει ιδιαίτερο κίνδυνο για τον άνθρωπο. Δεν έχει διεξαχθεί μελέτη με το ADAMTS13R για να αξιολογήσει το μεταλλαξιογόνο ή το καρκινογόνο του δυναμικό.
ασυμβίβαστες |
Ελλείψει μελετών συμβατότητας, αυτό το φάρμακο δεν πρέπει να αναμειγνύεται με άλλα φάρμακα.
Επίσημη διατήρηση |
Ανοίξτε
3 ετών
μετά την ανασυγκρότηση
Η φυσικοχημική σταθερότητα κατά τη διάρκεια της χρήσης έχει αποδειχθεί για 6 ώρες στους 25 ° C.
Από μικροβιολογική άποψη, το φάρμακο πρέπει να χρησιμοποιηθεί αμέσως, εκτός εάν η μέθοδος ανοίγματος/ανακατασκευής/αραίωσης. Εάν δεν χρησιμοποιείται αμέσως, οι διάρκειες και οι συνθήκες διατήρησης στη χρήση εμπίπτουν στην ευθύνη του χρήστη.
Προφυλάξεις Ειδική Διατήρηση |
σκόνη
να διατηρηθεί στο ψυγείο (μεταξύ 2 ° C και 8 ° C).
Μην παγώσετε. | Αρχικά, προστατευμένο από το φως.
À conserver dans l'emballage d'origine, à l'abri de la lumière.
Το Adzynma μπορεί να διατηρηθεί σε θερμοκρασία δωματίου έως 30 ° C για περίοδο έως 6 μηνών σε λυοφιλοποιημένη μορφή, αλλά χωρίς να υπερβαίνει την ημερομηνία λήξης.
Μην βάζετε το Adzynma πίσω στο ψυγείο αφού το έχετε κρατήσει σε θερμοκρασία περιβάλλοντος. | Ήταν έξω από το ψυγείο.
Noter sur l'emballage la date à laquelle ADZYNMA a été sorti du réfrigérateur.
μετά την ανασύσταση
Για τις συνθήκες διατήρησης του φαρμάκου μετά την ανασυγκρότηση, ανατρέξτε στην ενότητα από τη διατήρηση.
= συγκεκριμένες προφυλάξεις για εξάλειψη και χειραγώγηση |
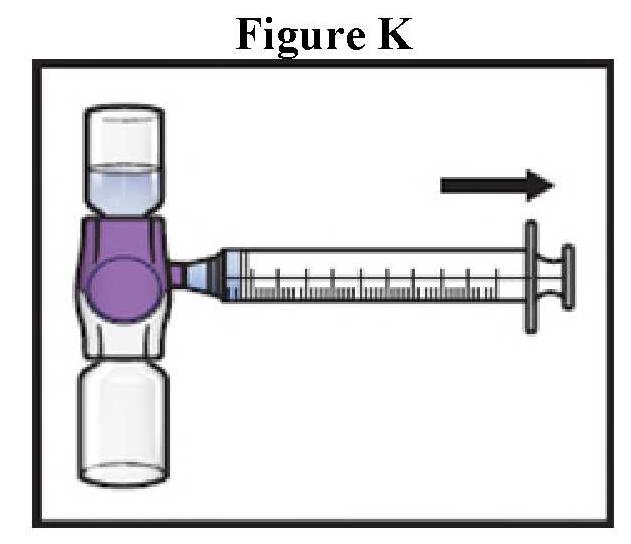
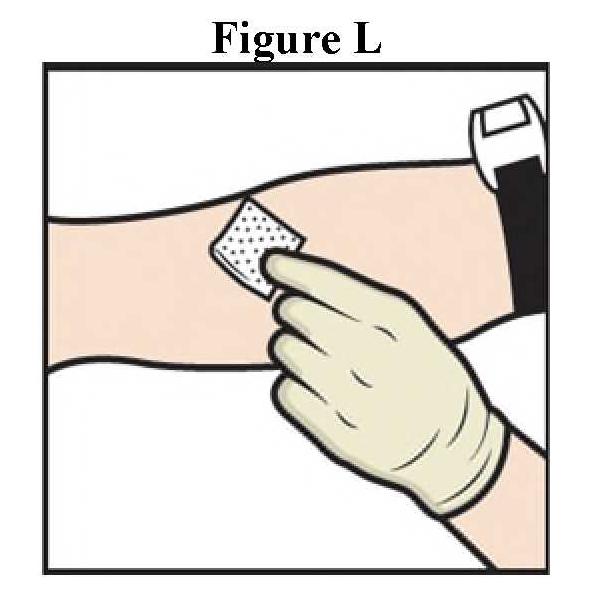
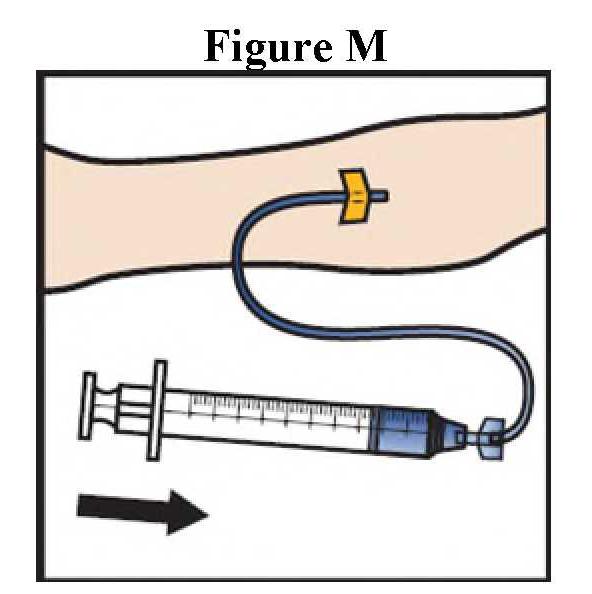
Το Adzynma πρέπει να χορηγείται με τον τρόπο ενδοφλέβια μετά την ανασύσταση της σκόνης με νερό για ενέσιμα παρασκευάσματα που παρέχονται.
Γενικές οδηγίες
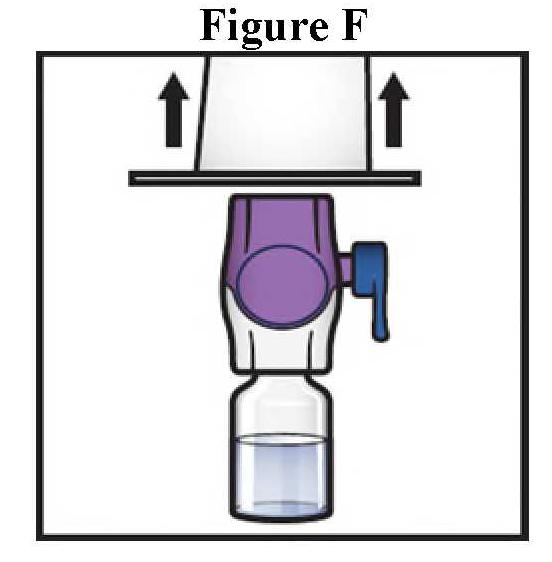
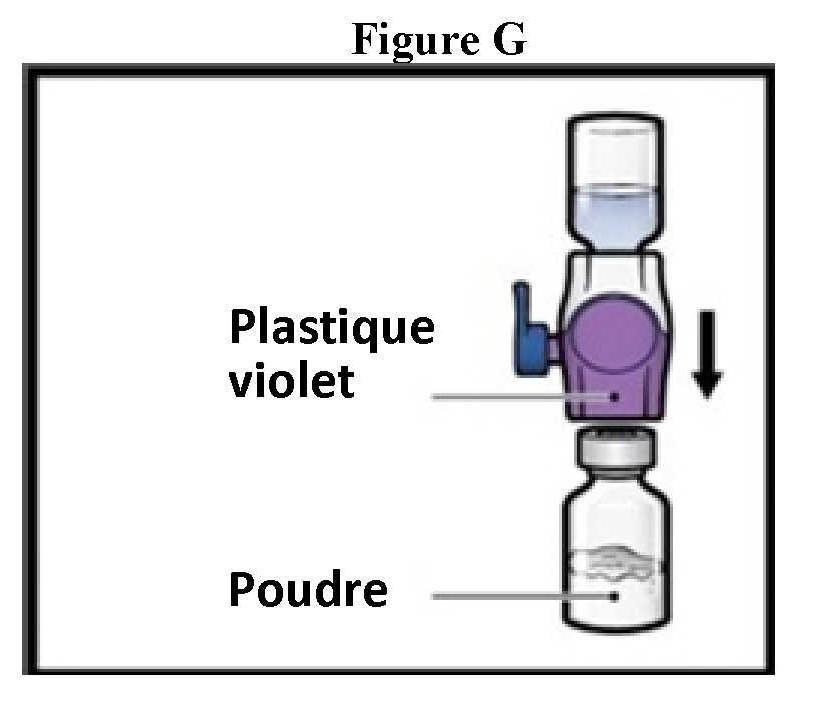
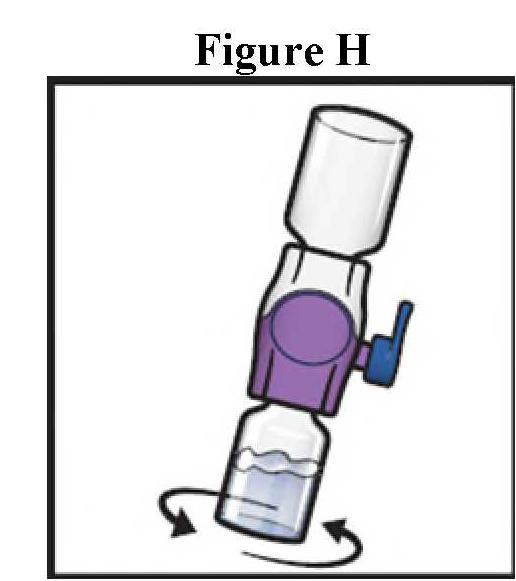
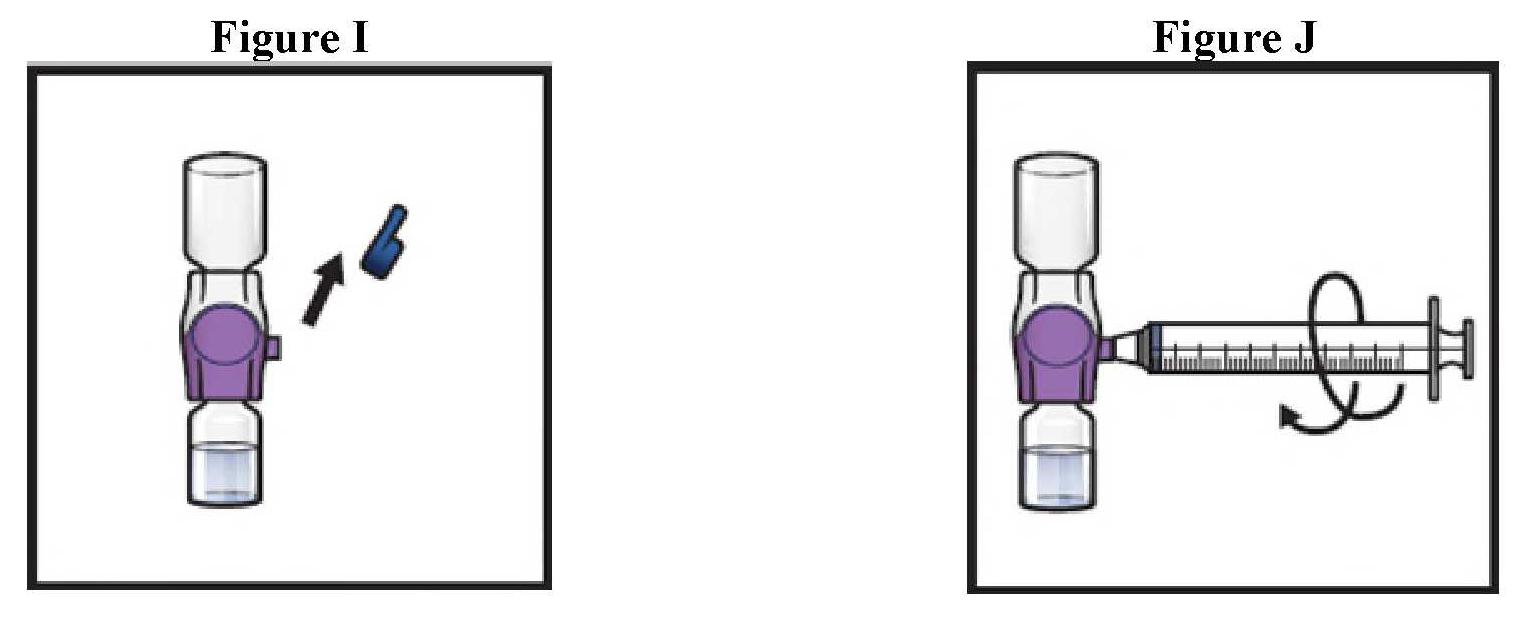
ανασύσταση
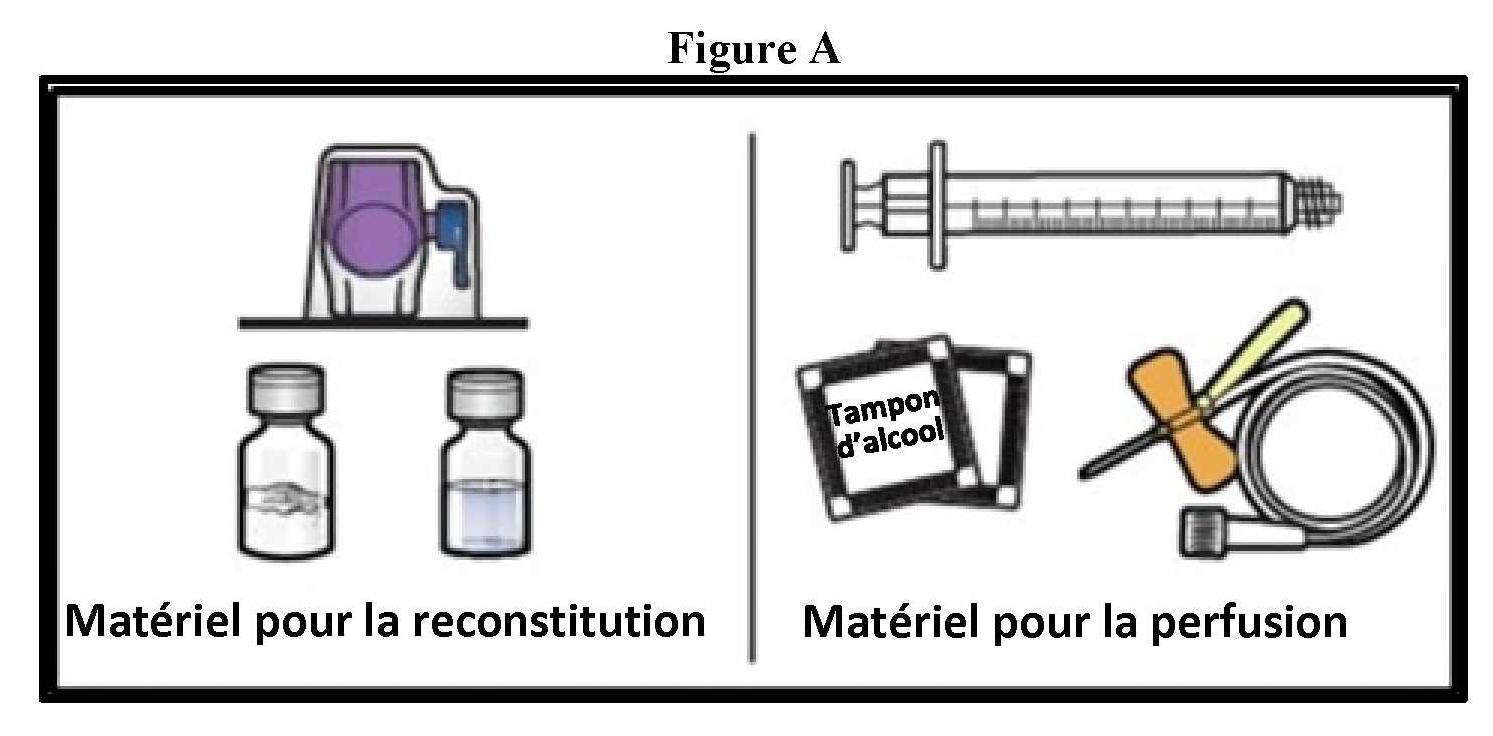 |
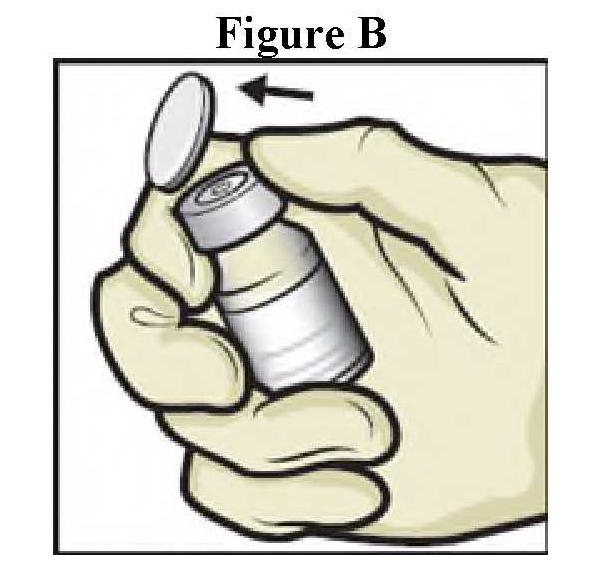 |
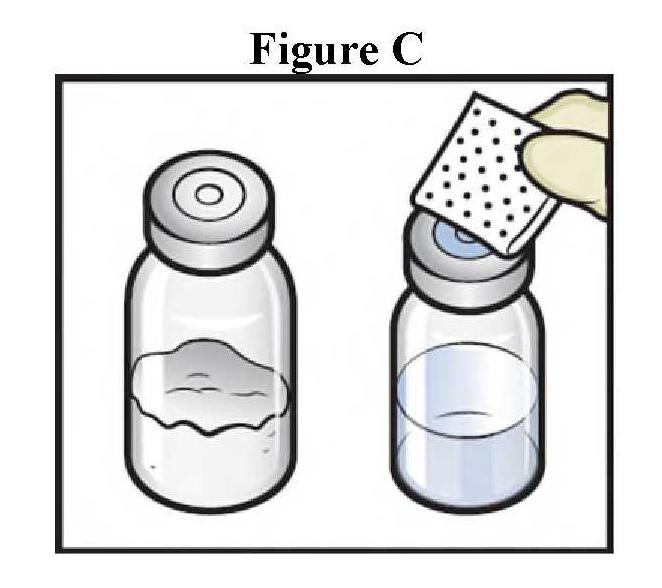 |
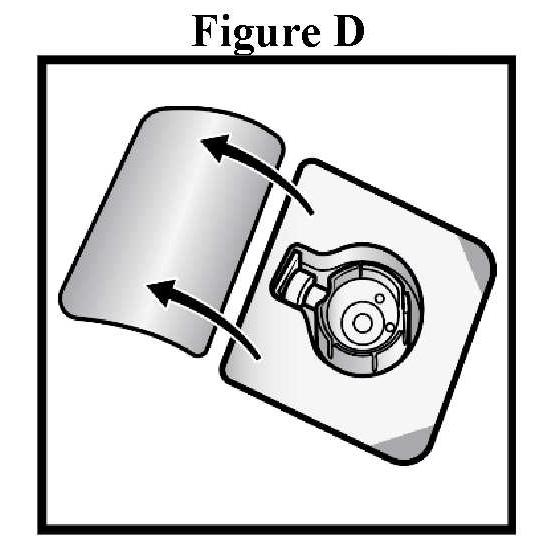 |
 |
 |
 |
 |
 |
 |
 |
 |
Οποιοδήποτε μη χρησιμοποιούμενο φάρμακο ή απόβλητα πρέπει να εξαλειφθεί σύμφωνα με τους τοπικούς κανονισμούς που ισχύουν.
= συνταγή/απελευθέρωση/υποστήριξη |
| amm |
|
Δεν επιστρέφεται και δεν έχει εγκριθεί συλλογή. Κάτω από την AMM, κατά την ημερομηνία 22.04.2025 (αιτήσεις για μελέτη).
Υποστήριξη για την έγκαιρη πρόσβαση (άρθρο L.162-16-5-1 του κώδικα κοινωνικής ασφάλισης) στην ένδειξη ενζυματική υποκαταστατική θεραπεία (TES) σε ενήλικες και παιδιά με ενήλικες με εγκληματική θρομβοκυτταροπενική σε ένα έλλειμμα ADAMTS13.
συνταγή σύμφωνα με το Πρωτόκολλο Collection και Συλλογής Δεδομένων.
| AMM |
|
Δεν επιστρέφεται και δεν έχει εγκριθεί συλλογή. Κάτω από την AMM, κατά την ημερομηνία 22.04.2025 (αιτήσεις για μελέτη).
Υποστήριξη για την έγκαιρη πρόσβαση (άρθρο L.162-16-5-1 του κώδικα κοινωνικής ασφάλισης) στην ένδειξη ενζυματική υποκαταστατική θεραπεία (TES) σε ενήλικες και παιδιά με ενήλικες με θρομβοκυτταροπενικό Purpura σε έλλειμμα στο ADAMTS13.
συνταγή σύμφωνα με το Πρωτόκολλο Collection και Συλλογής Δεδομένων.