Veuillez saisir au moins 3 caractères pour votre recherche.
Περίληψη
Έκδοτο του διαλύτη: Νερό PPI
een χωρίς όριο δόσης: Polysorbate 80
EEN με όριο δόσης: Δόση κατωφλίου: νάτριο
CIP: 3400958720291
Modalités de conservation : Avant ouverture : < 25° durant 6 mois (A conserver à température ambiante, Conserver à l'abri de la lumière, Conserver dans son emballage), 2° < t < 8° durant 24 mois (Conserver à l'abri de la lumière, Conserver dans son emballage, Conserver au réfrigérateur, Ne pas congeler)
Μορφές και παρουσιάσεις |
σκόνη (έγκλημα, λευκό έως ελαφρώς γκρίζο) και διαλύτη (κρυστάλλινο και άχρωμο διάλυμα) για διάλυμα έγχυσης.
= Ελέγχου που περιέχει: 1 μπουκάλι σκόνης +1 μπουκάλι 2 ml διαλύτη* avec système prêt à l'emploi (Baxject III) dans une plaquette scellée.
* Η φιάλη σκόνης και η φιάλη διαλύτη προτιμούνται στο σύστημα ανακατασκευής.
Σύνθεση |
Κάθε μπουκάλι περιέχει ονομαστικά 250 UI*του Παράγοντα VIII ανθρώπινη πήξη, Octocog alfa **. Η συμβουλή περιέχει περίπου 125 IU από ML του παράγοντα VIII (rDNA) της ανθρώπινης πήξης, Octocog alfa μετά την ανασυγκρότηση.
*Ο τίτλος (διεθνής μονάδα) καθορίζεται με χρωμογενή δοσολογία, σύμφωνα με την Ευρωπαϊκή Φαρμακοποιία. Η συγκεκριμένη δραστηριότητα της συμβουλευτικής είναι περίπου 4.520-11 300 IU/mg πρωτεΐνης.
** Το Octocog alfa (παράγοντας VIII της ανθρώπινης πήξης (rDNA)) είναι μια καθαρισμένη πρωτεΐνη, η οποία έχει 2.332 αμινοξέα. Παράγεται με την τεχνική ανασυνδυασμένου DNA σε κύτταρα ωοθηκών κινεζικών χάμστερ (CHO). Παρασκευάζεται χωρίς προσθήκη πρωτεΐνης (εξωγενής) ανθρώπινης ή ζωικής προέλευσης κατά τη διάρκεια των σταδίων της κυτταρικής καλλιέργειας, του καθαρισμού ή της τελικής διατύπωσης.
υπολείμματα κατασκευής: Πρωτεΐνες ποντικιού και χάμστερ.
= Εκδότες με περιβόητο αποτέλεσμα: | 0,45 mmol του νατρίου (10 mg) με μπουκάλι.
Ce médicament contient 0,45 mmol de sodium (10 mg) par flacon.
σκόνη: μαννιτόλη, χλωριούχο νάτριο, ιστιδίνη, τρωσταλία, χλωριούχο ασβέστιο, τρομεταμόλη, πολυσορβικό 80, γλουταθειόν (μειωμένη).
Solvant: νερό για αποστειρωμένα ενέσιμα παρασκευάσματα.
Ενδείξεις |
Θεραπεία και προφύλαξη αιμορραγικών επεισοδίων σε ασθενείς με αιμοφιλία Α (συγγενές έλλειμμα στον παράγοντα VIII). Η συμβουλή υποδεικνύεται σε όλες τις ηλικιακές ομάδες.
Δοσολογία και τρόπος διαχείρισης |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
Αντενδείξεις |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Τοποδυτικότητα
Για να βελτιωθεί η ανιχνευσιμότητα των βιολογικών φαρμάκων, πρέπει να καταγραφεί το όνομα και ο αριθμός της παρτίδας του χορηγούμενου προϊόντος.
Υπεραισθησία
= αντιδράσεις υπερευαισθησίας του αλλεργικού τύπου, ιδιαίτερα αναφυλαξίας, αναφέρθηκαν με συμβουλή. Το προϊόν περιέχει ίχνη πρωτεΐνης ποντικού και χάμστερ. Σε περίπτωση συμπτωμάτων υπερευαισθησίας, οι ασθενείς θα πρέπει να ενημερώνονται αμέσως για τη διαχείριση του προϊόντος και να επικοινωνήσουν με τον γιατρό τους. Οι ασθενείς θα πρέπει να ενημερώνονται για τα πρώτα σημάδια αντιδράσεων υπερευαισθησίας, συμπεριλαμβανομένης της κνίδωσης, γενικευμένων κυψέλων, καταπίεσης του στήθους, αναπνοής, υπόταση και αναφυλαξία.
Σε περίπτωση σοκ, πρέπει να καθοριστεί η τυπική θεραπεία που σχετίζεται με την κατάσταση σοκ.
Λόγω της μείωσης του όγκου της συμβουλευτικής έγχυσης που ανακατασκευάστηκε σε 2 mL νερού για αποστειρωμένα ενέσιμα παρασκευάσματα, ο χρόνος αντίδρασης και διακοπής της ένεσης σε περίπτωση αντίδρασης υπερευαισθησίας είναι ακόμη πιο σύντομη. Ως εκ τούτου, είναι σκόπιμο να είστε προσεκτικοί κατά τη διάρκεια της έγχυσης συμβουλών που ανασυστάθηκαν σε 2 ml νερού για αποστειρωμένα ενέσιμα παρασκευάσματα, ιδίως σε παιδιά.
Αναστολείς
Η εμφάνιση εξουδετερωτικών αντισωμάτων (αναστολείς) του παράγοντα VIII είναι μια γνωστή επιπλοκή της θεραπείας των ασθενών που επηρεάζονται από αιμοφιλία Α. Αυτοί οι αναστολείς είναι συνήθως ανοσοσφαιρίνες IgG που κατευθύνονται από την πλακώδη δράση του παράγοντα VIII και μετράται σε μονάδες Bethesda με mL πλέγμα με τροποποιημένη δοκιμή. Ο κίνδυνος ανάπτυξης αναστολέων συσχετίζεται με τη σοβαρότητα της νόσου καθώς και την έκθεση στον παράγοντα VIII, ο οποίος είναι ο υψηλότερος κατά τις πρώτες 20 ημέρες έκθεσης. Σπάνια, οι αναστολείς μπορούν να εμφανιστούν μετά τις πρώτες 100 ημέρες έκθεσης.
των περιπτώσεων επανεμφάνισης αναστολέων (χαμηλός τίτλος) παρατηρήθηκαν μετά την αλλαγή ενός παράγοντα VIII για έναν άλλο, σε ασθενείς που είχαν προηγουμένως υποβληθεί σε θεραπεία με περισσότερες από 100 ημέρες έκθεσης και που είχαν ιστορικό ανασταλτικής ανάπτυξης. Συνεπώς, συνιστάται να παρακολουθείτε προσεκτικά όλους τους ασθενείς προκειμένου να ανιχνευθεί η εμφάνιση ενός αναστολέα μετά από αλλαγή του προϊόντος.
Η κλινική σημασία της εμφάνισης των αναστολέων θα εξαρτηθεί από τον τίτλο των αναστολέων. Ένας χαμηλός τίτλος προσωρινών ή σταθερών αναστολέων παρουσιάζει χαμηλότερο ανεπαρκή κίνδυνο κλινικής απόκρισης από έναν υψηλό τίτλο αναστολέων.
Γενικά, όλοι οι ασθενείς που έλαβαν θεραπεία με προϊόντα πήξης VIII πρέπει να υπόκεινται σε προσεκτική παρακολούθηση για την ανίχνευση της εμφάνισης αναστολέων με κλινική παρακολούθηση και τη χρήση κατάλληλων βιολογικών δοκιμών. Εάν δεν επιτευχθεί ο αναμενόμενος ρυθμός παράγοντα πλάσματος ή εάν η αιμορραγία δεν ελέγχεται από επαρκή δόση, πρέπει να πραγματοποιηθεί δοσολογία προκειμένου να αναζητηθεί η παρουσία ενός αναστολέα παράγοντα VIII. Σε ασθενείς με υψηλό τίτλο αναστολέα, η θεραπεία με παράγοντα VIII μπορεί να μην είναι αποτελεσματική και πρέπει να ληφθούν υπόψη άλλες θεραπευτικές επιλογές. Η παρακολούθηση τέτοιων ασθενών πρέπει να διεξάγεται από γιατρούς που βιώνουν στη διαχείριση της αιμοφιλίας και των αναστολέων του παράγοντα VIII.
Διοίκηση Advantic
Η λανθασμένη χορήγηση (με ενδοκοιλιακή ή εκτός φλέβας) που πρέπει να ανασυσταθεί με 2 mL νερού για αποστειρωμένα ενέσιμα παρασκευάσματα μπορεί να προκαλέσει μεταβατικές αντιδράσεις φωτός στη θέση έγχυσης, όπως το Blues και το Erythema.
Επιπλοκές που σχετίζονται με τον καθετήρα κατά τη διάρκεια της θεραπείας
Si un dispositif d'accès veineux central (DAVC) est requis, le risque de complications liées au DAVC, notamment des infections locales, une bactériémie et une thrombose au site du cathéter, doit être pris en compte.
Σκέψεις που συνδέονται με το excipient
νάτριο
Αυτό το φάρμακο περιέχει 10 mg νατρίου ανά φιάλη, το οποίο ισοδυναμεί με το 0,5% της μέγιστης ημερήσιας πρόσληψης τροφής που συνιστάται από τα 2 g νατρίου από τον ενήλικα. | Κάθε χορήγηση συμβουλών σε έναν ασθενή, το όνομα και ο αριθμός παρτίδας του προϊόντος καταγράφονται προκειμένου να διατηρηθεί μια σύνδεση μεταξύ του ασθενούς και του αριθμού παρτίδας του φαρμάκου.
Il est fortement recommandé qu'à chaque administration d'ADVATE à un patient, le nom et le numéro de lot du produit soient enregistrés afin de maintenir un lien entre le patient et le numéro de lot du médicament.
Παιδιατρικός πληθυσμός:
Ο κατάλογος των προειδοποιήσεων και των προφυλάξεων ισχύει τόσο για τους ενήλικες όσο και για τα παιδιά.
αλληλεπιδράσεις |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
Γονιμότητα/εγκυμοσύνη/θηλασμός |
Aucune étude de reproduction animale n'a été conduite avec le facteur VIII. En raison de la rareté de l'hémophilie A chez la femme, il n'y a pas de donnée disponible sur l'utilisation de facteur VIII lors de la grossesse ou de l'allaitement. En conséquence, le facteur VIII ne doit être utilisé pendant la grossesse ou l'allaitement qu'en cas de nécessité absolue.
Οδήγηση και χρήση μηχανών |
Το συμβούλιο δεν έχει καμία επίδραση στην ικανότητα οδήγησης οχημάτων και χρήσης μηχανών.
ανεπιθύμητα αποτελέσματα |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
υπερβολική δόση |
Δεν έχει αναφερθεί ανασυνδυασμένος παράγοντας πήξης VIII.
Φαρμακοδυναμική |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
Φαρμακινητική |
Συνδέστε τον εαυτό σας για πρόσβαση σε αυτό το περιεχόμενο
Προκλινική |
Τα μη κλινικά δεδομένα που προκύπτουν από μελέτες φαρμακολογίας ασφαλείας, οξεία τοξικολογία, τοξικότητα στην επαναλαμβανόμενη χορήγηση, τοπική τοξικότητα και γονοτοξικότητα δεν έχουν αποκαλύψει ιδιαίτερο κίνδυνο για τον άνθρωπο.
Μελέτη της τοπικής ανοχής στα κουνέλια έχει αποδείξει ότι η συμβουλή ανασυγκρότησε με 2 mL νερού για ενέσιμα παρασκευάσματα καλά ανεκτά μετά από ενδοφλέβια χορήγηση. Μία ελαφριά μεταβατική ερυθρότητα στο σημείο χορήγησης παρατηρήθηκε μετά από ενδοκερική χορήγηση και μετά τη χορήγηση κοντά στη φλέβα. Παρ 'όλα αυτά, δεν μπορεί να παρατηρηθεί συνδεδεμένη ανεπιθύμητη ιστοπαθολογική αλλαγή, η οποία επιβεβαιώνει τη μεταβατική φύση αυτού του αποτελέσματος.
ασυμβίβαστες |
Ελλείψει μελετών συμβατότητας, αυτό το φάρμακο δεν πρέπει να αναμειγνύεται με άλλα φάρμακα ή διαλύτες. | χρόνια.
DURÉE DE CONSERVATION |
Deux ans.
Μετά την ανασυγκρότηση, από μικροβιολογική άποψη, το προϊόν πρέπει να χρησιμοποιηθεί αμέσως. Ωστόσο, η χημική και φυσική σταθερότητα στη χρήση έχει αποδειχθεί για 3 ώρες στους 25 ° C
Κατά τη διάρκεια της διάρκειας ζωής, το προϊόν μπορεί να διατηρηθεί σε θερμοκρασία δωματίου (που δεν υπερβαίνει τους 25 ° C) για μία μόνο περίοδο 6 μηνών. Το τέλος της περιόδου των 6 μηνών αποθήκευσης σε θερμοκρασία δωματίου πρέπει να αναφέρεται στη συσκευασία. Το προϊόν δεν πρέπει να δίνεται στο ψυγείο.
Ειδικές προφυλάξεις συντήρησης |
να διατηρηθεί στο ψυγείο (μεταξύ 2 ° C και 8 ° C). Μην παγώσετε.
Διατηρήστε το σφραγισμένο φυλλάδιο στην εξωτερική συσκευασία στο καταφύγιο του φωτός.
Για τις συνθήκες διατήρησης της λύσης μετά την ανασυγκρότηση, βλ. Ενότητα Επίσημη διατήρηση.
Συμμετοχή εξάλειψης και χειραγώγησης |
Η παροχή συμβουλών πρέπει να χορηγείται ενδοφλεβίως μετά την ανασυγκρότηση του προϊόντος.
Η ανασυσταθείσα διάλυμα πρέπει να επιθεωρείται οπτικά για να επισημανθεί η παρουσία ξένων σωματιδίων και/ή ενός μη φυσιολογικού χρωματισμού. | σωματίδια. || 937
Après reconstitution, la solution est limpide, incolore et exempte de particules.
Ne pas utiliser de solution trouble ou présentant des dépôts.
ανασύσταση με το σύστημα Baxject III
Μην χρησιμοποιείτε εάν το καπάκι δεν είναι πλήρως σφραγισμένο στο φυλλάδιο.
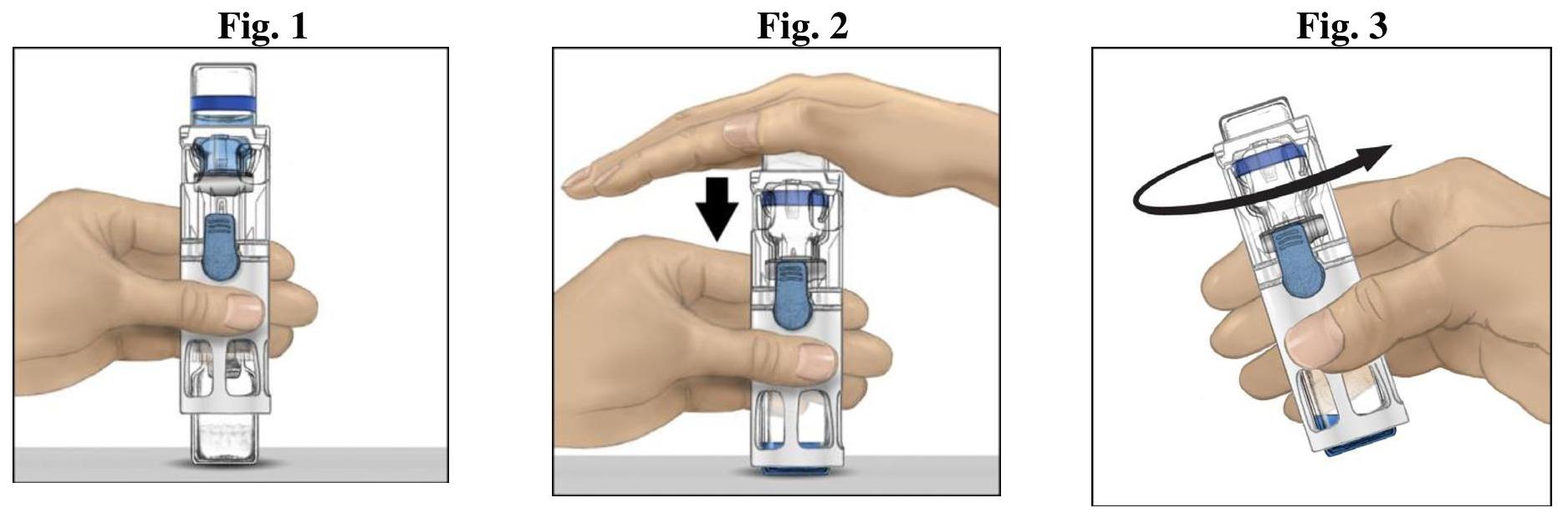
Διαχείριση
Utiliser une technique aseptique.
Πριν από τη χορήγηση, η αναζήτηση για αιωρούμενα σωματίδια πρέπει να διεξάγεται σε όλα τα ενέσιμα φάρμακα όταν το διάλυμα και το δοχείο το επιτρέπουν. Χρησιμοποιήστε μόνο τη λύση εάν είναι κρυστάλλινο και άχρωμο.
συνταγή/απελευθέρωση/καπάκι Κατάλογος i |
| AMM |
|