| σκόνη: | από το μπουκάλι |
Alteplase* (DCI)
| 10 mg (5.8 MUI) |
| ή | (11.6 mui) | 20 mg (11,6 MUI) |
| ή | 50 mg (29 MUI) |
Έκδορα: Αργινίνη, φωσφορικό οξύ (για την ρύθμιση του ρΗ), Polysorbate 80.
Solvant: νερό για παρασκευάσματα ενέσιμα.
* Η AltePlase παράγεται από την τεχνική ανασυνδυασμένου DNA σε μια κυτταρική γραμμή ωοθηκών του κινεζικού χάμστερ.
Η ειδική δραστηριότητα της εσωτερικής ουσίας αναφοράς είναι 580.000 IU/mg, η τιμή αυτή επιβεβαιώνεται σε σύγκριση με το δεύτερο διεθνές πρότυπο. Η προδιαγραφή για τη συγκεκριμένη δραστηριότητα της αλτεπής είναι από 522.000 έως 696.000 IU/mg.
-
Θρομβολυτική θεραπεία στην οξεία φάση του εμφράγματος του μυοκαρδίου:
-
- = Θεραπευτικό διάγραμμα που ονομάζεται "επιταχυνόμενο" (90 λεπτά) (|| Διαχείρισηcf Posologie et Mode d'administration): Προορίζεται για ασθενείς στους οποίους η θεραπεία μπορεί να ξεκινήσει εντός 6 ωρών από την εμφάνιση των συμπτωμάτων.
- = Rapeutic Διάγραμμα που ονομάζεται "3 ώρες" ( CF Μέθοδος δοσολογίας και χορήγησης): Προορίζεται για ασθενείς στους οποίους η θεραπεία μπορεί να ξεκινήσει μεταξύ 6 και 12 ωρών μετά την εμφάνιση 6 και 12 ωρών μετά τα συμπτώματα, υπό την προϋπόθεση ότι η ένδειξη είναι εμφανής.
- Η Alteplase καθιστά δυνατή τη μείωση του ποσοστού θνησιμότητας σε 30 ημέρες μετά το έμφραγμα του μυοκαρδίου.
-
Θρομβολυτική θεραπεία μετά από μαζική πνευμονική εμβολή στην οξεία φάση με αιμοδυναμική αστάθεια:
- Η διάγνωση πρέπει να επιβεβαιωθεί, όσο το δυνατόν περισσότερο, με αντικειμενικές μεθόδους (αγγειογραφία, σαρωτή).
- Δεν υπάρχει απόδειξη κέρδους όσον αφορά την νοσηρή θνησιμότητα σε αυτή την ένδειξη. Ινωδολυτικό του ισχαιμικού εγκεφαλικού επεισοδίου στην οξεία φάση:
-
Traitement fibrinolytique de l'accident vasculaire cérébral ischémique à la phase aiguë :
- Η θεραπεία πρέπει να εισαχθεί το συντομότερο δυνατόν εντός της 4:30 π.μ. μετά την εμφάνιση των συμπτωμάτων του εγκεφαλικού επεισοδίου και αφού αποκλείσει μια ενδοκρανιακή αιμορραγία με κατάλληλες τεχνικές απεικόνισης (για παράδειγμα, εγκεφαλική τομοδινωτομομετρία ή άλλη μέθοδο αιμορραγίας απεικόνισης). Η επίδραση της θεραπείας εξαρτάται από το χρόνο. Κατά συνέπεια, όσο περισσότερο η θεραπεία χορηγείται νωρίς, τόσο περισσότερο η πιθανότητα ευνοϊκού κλινικού αποτελέσματος είναι υψηλή.
Προειδοποιήσεις και προφυλάξεις για χρήση |
Τοποδυτικότητα: Για να βελτιωθεί η ανιχνευσιμότητα των βιολογικών φαρμάκων, πρέπει να καταγραφεί σαφώς ο αριθμός και ο αριθμός παρτίδας του χορηγούμενου προϊόντος.
Η κατάλληλη παρουσίαση του Acttlese πρέπει να επιλεγεί προσεκτικά και σύμφωνα με την προγραμματισμένη χρήση. Το μπουκάλι των 2 mg αλτεπλάσης δεν είναι κατάλληλο για χρήση στην οξεία φάση του εμφράγματος του μυοκαρδίου, μαζική πνευμονική εμβολή στην οξεία φάση ή ισχαιμικό εγκεφαλικό επεισόδιο (λόγω σημαντικού κινδύνου επικλινής). Μόνο τα μπουκάλια των 10 mg, 20 mg και 50 mg υποδεικνύονται για αυτές τις χρήσεις.
Tout traitement thrombolytique/fibrinolytique nécessite une prise en charge adaptée. Actilyse ne doit être utilisé que sous la responsabilité et le suivi de médecins formés et expérimentés dans l'utilisation des agents thrombolytiques et disposant des moyens de surveillance adéquats. Il est recommandé d'administrer Actilyse au sein de structures disposant en permanence d'équipements et de traitements de réanimation.
-
Υπεραισθησία:
- Οι αντιδράσεις υπερευαισθησίας με ανοσολογική διαμεσολάβηση που σχετίζονται με τη χορήγηση του Actilyse μπορεί να προκληθεί από την ενεργή ουσία αλτεπλάσης ή ένα από τα έκδοχα. | Σκηνοθετείται ενάντια στο ανασυνδυασμένο μόριο του ενεργοποιητή ιστού του ανθρώπινου πλασμινογόνου παρατηρήθηκε μετά τη θεραπεία. Δεν υπάρχουν δεδομένα σχετικά με μια ενεργή αναχώρηση.
- Aucune formation durable d'anticorps dirigés contre la molécule recombinante d'activateur tissulaire du plasminogène humain n'a été observée après le traitement. Il n'y a pas de données relatives à une réadministration d'Actilyse.
- Υπάρχει επίσης ο κίνδυνος αντιδράσεων υπερευαισθησίας, που προκαλούνται από έναν μη -ανοσολογικό μηχανισμό.
- Η αντίδραση υπερευαισθησίας που αναφέρεται συχνότερα με το Actilyse είναι το οίδημα του Quincke. Ο κίνδυνος μπορεί να αυξηθεί στην περίπτωση ισχαιμικού εγκεφαλικού επεισοδίου στην οξεία φάση και/ή με τη λήψη ταυτόχρονης θεραπείας με βάση το ένζυμο του ενζύμου μετατροπής αγγειοτενσίνης (|| 814 cf Interactions). Ο κίνδυνος οίδημα Quincke πρέπει να παρακολουθείται σε ασθενείς που υποβλήθηκαν σε αγωγή ανεξάρτητα από την εξουσιοδοτημένη ένδειξη, κατά τη διάρκεια της έγχυσης και εντός 24 ωρών από την έγχυση.
- Σε περίπτωση σοβαρής αντίδρασης υπερευαισθησίας (π.χ. οίδημα Quincke), η έγχυση πρέπει να διακόπτεται και να ξεκινήσει αμέσως η κατάλληλη θεραπεία. Αυτό μπορεί να περιλαμβάνει διασωλήνωση.
-
Αιμορραγίες:
- Η πιο συχνά συναντημένη επιπλοκή κατά τη διάρκεια της θεραπείας με Actilyse αιμορραγεί. Η ταυτόχρονη χρήση άλλων ενεργών ουσιών που δρουν στη πήξη ή τη λειτουργία των αιμοπεταλίων μπορεί να συμβάλει στην αιμορραγία. Κατά τη διάρκεια της θεραπείας με Actilyse, το ινώδες είναι Lysée, η οποία μπορεί να προκαλέσει αιμορραγία σε πρόσφατες θέσεις διάτρησης. Έτσι, οποιαδήποτε θρομβολυτική θεραπεία απαιτεί ιδιαίτερη προσοχή σε όλες τις πιθανές θέσεις αιμορραγίας (συμπεριλαμβανομένων εκείνων που ακολουθούν την εισαγωγή ενός καθετήρα, αρτηριακών ή φλεβικών σημείων διάτρησης, θέσεων τομής και σημείων δαγκώματος). Η χρήση άκαμπτων καθετήρων, ενδομυϊκών ενέσεων και μη ουσιώδεις παρεμβάσεις πρέπει να αποφεύγεται κατά τη διάρκεια της θεραπείας με Actilyse.
- Ινωολυτική θεραπεία και ταυτόχρονη θεραπεία με ηπαρίνη θα πρέπει να διακόπτεται αμέσως σε περίπτωση δυνητικά επικίνδυνης αιμορραγίας, ειδικά σε εγκεφαλική αιμορραγία. Σε γενικές γραμμές, ωστόσο, δεν είναι απαραίτητο να χορηγηθούν παράγοντες πήξης λόγω του μικρού χρόνου ημιζωής της αλτεπλάσης και των χαμηλών επιδράσεων της σε αυτούς τους συστηματικούς παράγοντες πήξης. Στις περισσότερες περιπτώσεις, η αιμορραγία μπορεί να ελεγχθεί με διακοπή των θρομβολυτικών και αντιπηκτικών θεραπειών, με τη χορήγηση ενός αγγειακού διαλύματος πλήρωσης ή με χειροκίνητη πίεση στο τραυματισμένο δοχείο. Μπορούμε να εξετάσουμε τη χρήση πρωταμίνης σε περίπτωση χορήγησης ηπαρίνης εντός 4 ωρών που προηγείται της εμφάνισης της αιμορραγίας. Σε σπάνιους ασθενείς που δεν πληρούν αυτά τα συντηρητικά μέτρα, μπορεί να ληφθεί υπόψη η κατάλληλη χρήση προϊόντων μετάγγισης. Η μετάγγιση της κρυοπορίας, η κατεψυγμένη φρέσκια πλάσμα ή οι πλάκες μπορεί να ληφθεί υπόψη με την παρακολούθηση των κλινικών και οργανικών παραμέτρων μετά από κάθε χορήγηση. Ο ρυθμός ινωδογόνου που πρέπει να επιτευχθεί σε περίπτωση που μια κρυοπροήτη έγχυση είναι 1 g/L. Η αντιφινολυτική συνιστά την τελευταία θεραπευτική εναλλακτική λύση.
- Ο κίνδυνος ενδοκρανιακής αιμορραγίας αυξάνεται στους ηλικιωμένους. Κατά συνέπεια, είναι απαραίτητο να αξιολογηθεί προσεκτικά ο δείκτης οφέλους/κινδύνου σε αυτόν τον τύπο ασθενούς.
- Όσον αφορά όλους τους θρομβολυτικούς παράγοντες, η χρήση της alteplase πρέπει να λαμβάνει προσεκτικά υπόψη τους πιθανούς κινδύνους και το θεραπευτικό όφελος που αναμένεται, ιδίως στις ακόλουθες περιπτώσεις:
- Πρόσφατο μικρό τραύμα, όπως βιοψίες, μεγάλα σκάφη, ενδομυϊκές ενέσεις, καρδιακό μασάζ κατά τη διάρκεια μιας ανάνηψης.
- Παθολογία που ενδέχεται να αυξήσει τον κίνδυνο αιμορραγίας και να μην εμφανιστεί στο τμήμα Αντενδείξεις.
-
-
Σε περίπτωση ταυτόχρονης θεραπείας από τα αντιπηκτικά στόματα:
- Η χρήση του Actilysis μπορεί να προβλεφθεί όταν η δόση ή η καθυστέρηση από την τελευταία αντιπηκτική θεραπεία παίρνει απίθανο ένα υπολειπόμενο αποτέλεσμα και ότι αυτό επιβεβαιώνεται από έναν ή πιο κατάλληλους δοκιμασίες (u) της αντιπηκτικής δραστηριότητας για τα άλλα προϊόντα (S) για τα άτομα που δεν παρουσιάζουν κλινικά σημαντική δραστηριότητα (S). Άλλα από του στόματος αντιπηκτικά δεν υπερβαίνουν το ανώτατο όριο του κανονικού).
-
Παιδιατρικός πληθυσμός:
- Παιδιά και έφηβοι.
- Όταν το Actilyse προβλέπεται ως θεραπεία του ισχαιμικού εγκεφαλικού επεισοδίου στην οξεία φάση των εφήβων ηλικίας 16 ετών και άνω, προσεκτικά επιλεγμένου, το όφελος της θεραπείας πρέπει να αξιολογηθεί προσεκτικά, σε σύγκριση με τους κινδύνους που εμπλέκονται. Αυτή η επιλογή πρέπει να συζητηθεί με τον ασθενή και τους γονείς ή τον δάσκαλο, εάν είναι απαραίτητο. Οι έφηβοι ηλικίας 16 ετών ή άνω πρέπει να αντιμετωπίζονται σύμφωνα με τις οδηγίες αυτής της μονογραφίας που δίνονται για ενήλικες ασθενείς, μετά από μια κατάλληλη τεχνική απεικόνισης που επιτρέπει την εξαίρεση παθολογιών που μιμούνται το εγκεφαλικό επεισόδιο και επιβεβαιώνοντας την αρτηριακή απόφραξη, που αντιστοιχεί στο νευρολογικό έλλειμμα (| Σε ιδιαίτερη φροντίδα και συγκεκριμένες προφυλάξεις για συμπληρωματική χρήση στις ενδείξεις του εμφράγματος του μυοκαρδίου στην οξεία φάση και την μαζική πνευμονική εμβολή στην οξεία φάση:cf Pharmacodynamie).
Mises en garde spéciales et précautions particulières d'emploi complémentaires dans les indications d'infarctus du myocarde à la phase aiguë et d'embolie pulmonaire massive à la phase aiguë :
Μην χορηγείτε δόση αλτεπλάσης μεγαλύτερη από 100 mg, λόγω της αύξησης του κινδύνου ενδοκρανιακής αιμορραγίας. | Βεβαιωθείτε ότι η δόση της χορηγούμενης αλτεπλάσης είναι τέτοια που περιγράφεται στην ενότητα
Des précautions particulières doivent être prises pour s'assurer que la dose d'altéplase administrée est telle que décrite dans la rubrique Δοσολογία και τρόπος διαχείρισης.
Η χρήση της alteplase πρέπει να λαμβάνει προσεκτικά υπόψη τους πιθανούς κινδύνους και το αναμενόμενο θεραπευτικό όφελος, ιδίως σε ασθενείς των οποίων η συστολική αρτηριακή πίεση είναι μεγαλύτερη από 160 mm Hg ( CF Αντενδείξεις) και σε άτομα μιας προχωρημένης ηλικίας επειδή αυτό μπορεί να αυξήσει τον κίνδυνο ενδοεγκεφαλικής αιμορραγίας. Το θεραπευτικό όφελος εξακολουθεί να είναι θετικό για τους ηλικιωμένους ασθενείς, πρέπει να διεξάγεται προσεκτικά αξιολόγηση του λόγου παροχών/κινδύνου.
Ανταγωνιστές των υποδοχέων GPIIB/IIIA: Η ταυτόχρονη χορήγηση ενός ανταγωνιστή του υποδοχέα GPIIB/IIIA αυξάνει τον κίνδυνο αιμορραγικής. | Σε περίπτωση εμφράγματος του μυοκαρδίου στην οξεία φάση:
Mises en garde spéciales et précautions particulières d'emploi en cas d'infarctus du myocarde à la phase aiguë :
-
Arhythmies:
- Μια στεφανιαία θρομβόλυση μπορεί να προκαλέσει αρρυθμία επαναιμάτωσης.
- Μια αρρυθμία επαναιμάτωσης μπορεί να προκαλέσει καρδιακή ανακοπή, να εμπλέξει τη ζωτική πρόγνωση και να απαιτήσει τη χρήση των αντιαρρυθμικών θεραπειών συμβατικών.
-
Thromboembolie:
- Η χρήση θρομβολυτικών μπορεί να αυξήσει τον κίνδυνο θρομβοεμβολικών συμβάντων σε ασθενείς με θρόμβο στην αριστερή καρδιά, όπως η στένωση της μιτροειδούς βαλβίδας ή μια κολπική μαρμαρυγή.
Mises en garde spéciales et précautions particulières d'emploi complémentaires en cas d'accident vasculaire cérébral ischémique à la phase aiguë :
-
Ειδικές προφυλάξεις για χρήση:
- Η εισαγωγή και η παρακολούθηση της θεραπείας πρέπει να διεξάγεται υπό την ευθύνη ενός γιατρού που σχηματίζεται και βιώνεται στη νευροαγγειακή παθολογία. Για τον έλεγχο της επιλογής της θεραπείας, μπορούν να θεωρηθούν κατάλληλα τα διαγνωστικά μέτρα απόστασης (τηλεϊατρική) ( CF ενδείξεις).
-
Ειδικές προειδοποιήσεις/πληθυσμοί που έχουν μείωση του λόγου παροχής/κινδύνου:
- Η ενδοεγκεφαλική αιμορραγία αντιπροσωπεύει το ισχαιμικό εγκεφαλικό επεισόδιο είναι οξύ στην οξεία φάση (έως και 15% των ασθενών χωρίς να αυξάνεται η συνολική θνησιμότητα και χωρίς σημαντική αύξηση του συνδυασμένου κριτηρίου συνδυασμένης συνολικής θνησιμότητας+μεγάλου μειονεκτήματος, δηλαδή παρουσιάζοντας βαθμολογία στην τροποποιημένη κλίμακα RANK (MRS) των 5 και 6).
- Σε σύγκριση με τις άλλες ενδείξεις, οι ασθενείς που υποβλήθηκαν σε θεραπεία με ένα Stratic Strat ισχαιμικό στην οξεία φάση παρουσιάζουν έντονη αύξηση του κινδύνου ενδοκρανιακής αιμορραγίας, αιμορραγίες που προτιμούν κατά προτίμηση στην περιοχή του εμφράγματος.
- Cette mise en garde s'applique notamment aux cas suivants :
- Οποιαδήποτε κατάσταση αναφέρεται στην παράγραφο Αντενδείξεις | Η κατάσταση υποδηλώνει σημαντικό αιμορραγικό κίνδυνο. et, plus généralement, toute situation impliquant un risque hémorragique important.
- Η περίοδος θεραπείας ανάλογα με την εμφάνιση συμπτωμάτων του εγκεφαλικού επεισοδίου, τόσο περισσότερο μειώνεται το καθαρό κλινικό κέρδος. Κατά συνέπεια, η διαχείριση της Actilysis δεν πρέπει να καθυστερήσει.
- Οι ασθενείς που έχουν λάβει προηγουμένως θεραπεία με ακετυλοσαλικυλικό οξύ (AAS) μπορεί να παρουσιάσουν αυξημένο κίνδυνο ενδοεγκεφαλικής αιμορραγίας, ιδίως εάν η θεραπεία με Actilyse τεθεί σε εφαρμογή αργά.
- Σε σύγκριση με τους νεότερους ασθενείς, ασθενείς με προχωρημένη ηλικία) μπορεί να έχουν λιγότερο καλά κλινικά αποτελέσματα ανεξάρτητα από τη θεραπεία. Είναι επίσης πιθανό να κάνουν πιο σοβαρό εγκεφαλικό επεισόδιο που σχετίζεται με απόλυτο κίνδυνο ενδοεγκεφαλικής αιμορραγίας σε περίπτωση θεραπείας θρομβόλυσης σε σύγκριση με το μέτριο εγκεφαλικό επεισόδιο που υποβλήθηκε σε θεραπεία με θρομβόλυση ή σε σύγκριση με ασθενείς που δεν υποβλήθηκαν σε θεραπεία με θρομβόλυση. Παρόλο που τα διαθέσιμα δεδομένα δείχνουν ότι το καθαρό κέρδος του Actilsse σε ασθενείς άνω των 80 ετών είναι χαμηλότερο από ό, τι σε νεότερους ασθενείς. Η Actilysis μπορεί να χρησιμοποιηθεί σε ασθενείς άνω των 80 ετών με βάση το όφελος και τον ατομικό κίνδυνο ( CF Pharmacodyics). Οι ασθενείς με προχωρημένη ηλικία πρέπει να επιλέγονται προσεκτικά λαμβάνοντας υπόψη τόσο τη γενική κατάσταση της υγείας όσο και της νευρολογικής κατάστασης.
- Το θεραπευτικό όφελος μειώνεται σε ασθενείς με ιστορικό εγκεφαλικού επεισοδίου (βλ. Επίσης το τμήμα Αντενδείξεις) ή παρουσιάζοντας έναν ανεξέλεγκτο διαβήτη. Σε αυτούς τους ασθενείς, ο λόγος κινδύνου οφέλους θεωρείται λιγότερο ευνοϊκός, αλλά παραμένει θετικός.
- Σε ασθενείς με πολύ μικρή μορφή εγκεφαλικού επεισοδίου, οι κίνδυνοι που συνδέονται με τη θεραπεία επικρατούν το αναμενόμενο κέρδος (|| 964 cf Contre-indications).
- Σοβαρή, να παρουσιάσει μεγαλύτερο κίνδυνο ενδοκρανιακής και θανάτου αιμορραγίας και δεν πρέπει να αντιμετωπίζεται με Actilyse.
- Οι ασθενείς που έχουν κάνει εκτεταμένη έμφραγμα έχουν αυξημένο κίνδυνο δυσμενούς εξέλιξης (συμπεριλαμβανομένων των σοβαρών και των αιμορραγιών του θανάτου). Ο λόγος οφέλους/κινδύνου πρέπει να αξιολογηθεί προσεκτικά σε αυτούς τους ασθενείς.
- Σε ασθενείς με εγκεφαλικό επεισόδιο, η πιθανότητα ευνοϊκής ανάπτυξης μειώνεται με την αύξηση του χρόνου επεξεργασίας από την εμφάνιση των συμπτωμάτων, με την ηλικία, με το βαθμό σοβαρότητας της βλάβης και με υψηλά ποσοστά σακχάρου στο αίμα, ενώ ο κίνδυνος σοβαρής αναπηρίας, θανάτου ή θανάτου ενδοκρανιακής αιμορραγίας αυξάνεται, ανεξάρτητα από τη θεραπεία.
- Η θεραπεία δεν πρέπει να ξεκινήσει αργότερα από 4,5 ώρες μετά την εμφάνιση των συμπτωμάτων, η ισορροπία του οφέλους/κινδύνου να καθίσταται δυσμενή οφειλόμενη:
-
- Μείωση της θετικής επίδρασης της θεραπείας με την πάροδο του χρόνου.
- ασθενείς που υποβλήθηκαν σε θεραπεία προηγουμένως με ακετυλοσαλικυλικό οξύ.
- αύξηση του κινδύνου συμπτωματικών αιμορραγιών.
-
Ordust of Blade Prestem:
- Η παρακολούθηση της αρτηριακής πίεσης πρέπει να τεθεί σε εφαρμογή κατά τη διάρκεια της διαχείρισης της θεραπείας και πρέπει να διατηρείται για 24 ώρες. Εάν η συστολική αρτηριακή πίεση είναι μεγαλύτερη από 180 mm Hg ή εάν η διαστολική αρτηριακή πίεση είναι μεγαλύτερη από 105 mm Hg, συνιστάται ενδοφλέβια αντιυπερτασική θεραπεία.
-
Autres mises en garde spéciales :
- Η επαναιμάτωση της περιοχής ισχαιμίας μπορεί να προκαλέσει οίδημα εγκεφάλου στην περιοχή του εμφράγματος. Λόγω του αυξημένου αιμορραγικού κινδύνου, δεν πρέπει να ξεκινήσει η θεραπεία με αντι-γήρανση Plattiaca εντός των πρώτων 24 ωρών μετά την θρομβολυτική θεραπεία με αλτεπλάση.
Γονιμότητα/εγκυμοσύνη/θηλασμός |
Grossesse :
Τα δεδομένα σχετικά με τη διαχείριση των αλυσίδων σε έγκυες γυναίκες είναι περιορισμένα. Οι μη κλινικές μελέτες που διεξήχθησαν με alteplase σε υψηλότερες δόσεις από εκείνες που χρησιμοποιούνται στον άνθρωπο έχουν αποκαλύψει την εμβρυϊκή ανωριμότητα και/ή την εμβρυοτοξικότητα δευτερογενώς στη γνωστή φαρμακολογική δραστηριότητα του προϊόντος. Το altéplase δεν θεωρείται τερατογόνο (|| 1034 cf Sécurité préclinique). Σε περίπτωση απειλής της ζωτικής σημασίας πρόγνωσης, είναι απαραίτητο να ληφθούν υπόψη τα αναμενόμενα οφέλη και οι πιθανοί κίνδυνοι.
Θηλασμός:
Δεν γνωρίζουμε αν η αλτεπλάση εκκρίνεται στο ανθρώπινο γάλα και τα δεδομένα σχετικά με την απέκκριση στο ζώο γάλα είναι περιορισμένα.
= Θηλασμός και απόφαση σχετικά με τη διακοπή του θηλασμού κατά τις πρώτες 24 ώρες μετά τη χρήση του Actilysis.
Γονιμότητα:
Δεν υπάρχουν κλινικά δεδομένα σχετικά με τη γονιμότητα που είναι διαθέσιμα για Actilyse. Οι μη κλινικές μελέτες που διεξήχθησαν με την Alteplase δεν έδειξαν καμία αρνητική επίδραση στη γονιμότητα ( CF προκλινική ασφάλεια).
Σύνδεση για να αποκτήσετε πρόσβαση σε αυτά τα περιεχόμενα
-
Συμπτώματα:
- Εάν υπερβεί η μέγιστη συνιστώμενη δόση, αυξάνεται ο κίνδυνος ενδοκρανιακής αιμορραγίας.
- Παρά τη σχετική εξειδίκευση της alteplase για ινώδη, μια υπερδοσολογία μπορεί να προκαλέσει κλινικά σημαντική μείωση του ινωδογόνου και σε άλλους παράγοντες της πήξης.
-
θεραπεία:
- Στις περισσότερες περιπτώσεις, αρκεί να περιμένουμε τη φυσιολογική αναγέννηση αυτών των στοιχείων μετά το τέλος της θεραπείας με Actilysy.
- Ωστόσο, αν συμβεί μια σοβαρή αιμορραγία, συνιστάται η μετάγγιση κατεψυγμένου φρέσκου πλάσματος, καθώς και, εάν είναι απαραίτητο, η χορήγηση συνθετικού αντι -ιβιβρινολυτικού.
Οι δοκιμές της υποχρονικής τοξικότητας στον αρουραίο και ο πίθηκος δεν υπογράμμισαν ένα απροσδόκητο αποτέλεσμα. | του μεταλλαξιογόνου δυναμικού.
Les tests de mutagenèse n'ont pas mis en évidence de potentiel mutagène.
Δεν παρατηρήθηκε τερατογόνο δράση μετά από ενδοφλέβια έγχυση φαρμακολογικά δραστικών δόσεων στην έγκυο θηλυκό. Η χορήγηση άνω των 3 mg/kg/ημέρα έχει προκαλέσει εμβρυοτοξικότητα (εμβρυϊκή θνησιμότητα, καθυστέρηση ανάπτυξης) στο κουνέλι. Δεν παρατηρήθηκε καμία επίδραση στη μόνιμη και μεταγεννητική ανάπτυξη και οι παράμετροι γονιμότητας σε δόσεις έως 10 mg/kg/ημέρα σε αρουραίους.
Το ανασυσταθισμένο διάλυμα μπορεί να αραιωθεί σε ένα αποστειρωμένο διάλυμα χλωριούχου νατρίου σε 0,9% σε ελάχιστη συγκέντρωση 0,2 mg αλτεπλάσης με ML.
Σε περίπτωση νέας αραίωσης, η χρήση νερού για ενέσιμα παρασκευάσματα ή γενικά η χρήση διαλυμάτων γλυκόζης για έγχυση, για παράδειγμα, η δεξτρόζη για παράδειγμα, λόγω του αυξημένου σχηματισμού θολερότητας στο ανασυσταμένο διάλυμα.
Η Actilysis δεν πρέπει να αναμειγνύεται με άλλα φάρμακα (συμπεριλαμβανομένης της ηπαρίνης), το ίδιο μπουκάλι για έγχυση ή στον ίδιο καθετήρα.
Ανοίξτε τα μπουκάλια:
Διάρκεια ανάγνωσης:
-
Actilyse 10 mg: 2 χρόνια.
-
Actilyse 20 mg et 50 mg : 3 ans.
για να κρατήσετε στην αρχική συσκευασία, προστατευμένη από το φως.
για να διατηρηθεί σε θερμοκρασία που δεν υπερβαίνει τους +25 ° C
Ανασυγκροτημένη λύση:
Η σταθερότητα του ανασυσταθισμένου διαλύματος αποδείχθηκε για 24 ώρες μεταξύ 2 ° C και 8 ° C, 25 ° C.
Από τη μικροβιολογική άποψη, το προϊόν πρέπει να χρησιμοποιείται αμέσως μετά την ανασυγκρότηση. Σε περίπτωση μη ερεθιστικής χρήσης, οι διάρκειες και οι συνθήκες διατήρησης μετά την ανασυγκρότηση και πριν από τη χρήση πέφτουν υπό την αποκλειστική ευθύνη του χρήστη και κανονικά δεν πρέπει να υπερβαίνουν τις 24 ώρες μεταξύ 2 ° C και 8 ° C
Διαχείριση/εξάλειψη των μεθόδων |
Προκειμένου να ληφθεί τελική συγκέντρωση 1 mg alteplase ανά ml, ο συνολικός όγκος του διαλύτη. που περιέχει τη σκόνη Actilyse. Για το σκοπό αυτό παρέχεται σωληνίσκο μεταφοράς με τις παρουσιάσεις των 20 και 50 mg. Για το μπουκάλι των 10 mg, πρέπει να χρησιμοποιείται σύριγγα.
Για να ληφθεί τελική συγκέντρωση 2 mg alteplase ανά ml, πρέπει να χρησιμοποιηθεί μόνο το ήμισυ του όγκου του παρεχόμενου διαλύτη (βλ. Πίνακα παρακάτω). Σε αυτή την περίπτωση, μια σύριγγα πρέπει πάντα να χρησιμοποιείται για την εισαγωγή του απαιτούμενου όγκου διαλύτη στη φιάλη που περιέχει το ενεργά λυοφιλικό.
Σε αυστηρές συνθήκες Asepsis, διαλύστε την αλτεπλάση (10, 20 ή 50 mg) σε όγκο νερού για ενέσιμα παρασκευάσματα σύμφωνα με τον ακόλουθο πίνακα, προκειμένου να ληφθεί τελική συγκέντρωση ή 1 mg d'Atléplase/ml ή 2 mg αλτεπλάσης/ml: || 1187
| Quantité de poudre d'Actilyse | 10 mg | 20 mg | 50 mg |
| (α) Αποστολής όγκος νερού για ενέσιμα παρασκευάσματα για να προσθέσετε σε σκόνη | 10 ml | 10 mL | 20 ml | 50 ml |
| Τελική συγκέντρωση: | 1 mg alteplase/ml | 1 mg alteplase/ml | 1 mg alteplase/ml | Αποστειρωμένο για ενέσιμα παρασκευάσματα για να προσθέσετε στη σκόνη |
| (b) Volume d'eau stérile pour préparations injectables à ajouter à la poudre | 5 ml | 10 ml | 25 ml |
| Τελική συγκέντρωση: | 2 mg alteplase/ml | 2 mg alteplase/ml | D'Altéplase/ml | 2 mg d'altéplase/ml |
Η ανασυσταθείσα λύση πρέπει στη συνέχεια να χορηγηθεί ενδοφλεβίως. Το ανασυσταθέν διάλυμα 1 mg/ml μπορεί να αραιωθεί περισσότερο με αποστειρωμένο διάλυμα ένεσης χλωριούχου νατρίου στα 9 mg/ml (0,9%) μέχρι μια ελάχιστη συγκέντρωση 0,2 mg/ml επειδή δεν μπορεί να αποκλειστεί την εμφάνιση της θολερότητας στο ανακατασκευασμένο διάλυμα. Δεν συνιστάται να αραιώνεται περαιτέρω το ανασυσταθέν διάλυμα 1 mg/ml μέσω νερού για ενέσιμα παρασκευάσματα ή γλυκιά ουσία (για παράδειγμα, η δεξτρόζη λόγω της αυξημένης κατάρτισης θολερότητας στο ανασυσταμένο διάλυμα). Η πράξη δεν πρέπει να αναμιγνύεται με άλλα φάρμακα (συμπεριλαμβανομένης της ηπαρίνης) στο ίδιο μπουκάλι έγχυσης.
για ασυμβίβαστες, CF ασυμβατότητες.
Η ανασυγκροτημένη λύση προορίζεται για μία μόνο χρήση. Οποιοδήποτε διάλυμα που δεν χρησιμοποιείται ή αποβλήτων πρέπει να εξαλειφθεί σύμφωνα με τους κανονισμούς που ισχύουν.
-
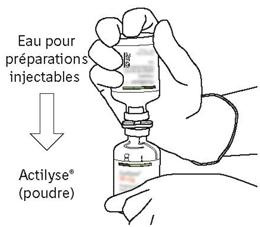
Οδηγίες για την ανασύσταση της Actilysis:
-
- ξαναχτίστηκε αμέσως πριν από τη διοίκηση.
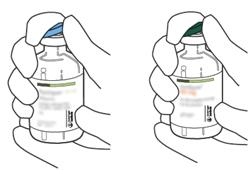
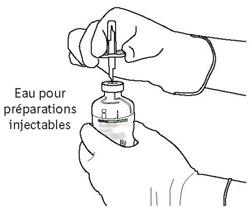
- Αφαιρέστε το προστατευτικό κάλυμμα των δύο μπουκαλιών που περιέχουν το νερό για ενέσιμα παρασκευάσματα και τη σκόνη του αναλογίας, ανυψώνοντας την ίντσα των καπακιών.
- Σκουπίστε την κορυφή του καουτσούκ κάθε μπουκάλι χρησιμοποιώντας ένα buffer εμποτισμένο με αλκοόλ.
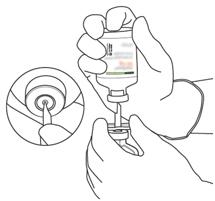
- Πάρτε το σωληνίσκο μεταφοράς* της περίπτωσής του. Μην απολυμαίνετε ή μην αποστειρώνετε τον σωληνίσκο μεταφοράς, είναι αποστειρωμένο. Αφαιρέστε ένα από τα καπάκια του.
*
(Εάν ένας σωληνίσκος μεταφοράς περιλαμβάνεται στο κουτί. Η ανασυγκρότηση μπορεί επίσης να γίνει με σύριγγα και βελόνα.)
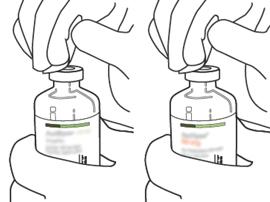
- Κρατήστε τη φιάλη που περιέχει το νερό για ενέσιμα παρασκευάσματα στην κατακόρυφη θέση και σε σταθερή επιφάνεια. Στην κορυφή της φιάλης, τρυπήστε το καουτσούκ με τον σωληνίσκο μεταφοράς, κάθετα και καλά στο κέντρο του βύσματος, πιέζοντας αργά αλλά σταθερά, χωρίς να γυρίζετε.
- Κρατήστε σταθερά τη φιάλη που περιέχει το νερό για ενέσιμα παρασκευάσματα και τον σωληνίσκο μεταφοράς με το ένα χέρι, χρησιμοποιώντας τα δύο πτερύγια σε κάθε πλευρά του σωληνίσκου. | Το Capuchon παραμένει στην κορυφή του σωληνίσκου μεταφοράς.
Retirez le capuchon restant sur le dessus de la canule de transfert.
- F με σταθερά κρατήστε το νερό που περιέχει το νερό για παρασκευάσματα έγχυσης και τον σωληνίσκο μεταφοράς με το ένα χέρι, χρησιμοποιώντας τα δύο πτερύγια σε κάθε πλευρά του σωληνίσκου.
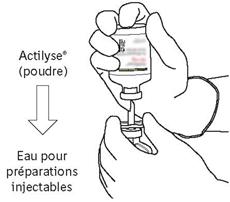
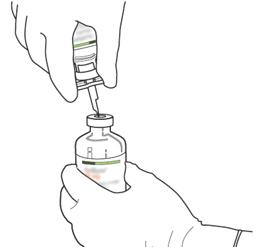
Πάρτε το μπουκάλι αναλογίας που περιέχει τη σκόνη και κρατήστε το κάθετα πάνω από το ελατήριο κέρατος μεταφοράς του σωληνίσκου μεταφοράς καλά στο κέντρο του βύσματος.
= Σπρώξτε τη φιάλη που περιέχει τη σκόνη στον σωληνίσκο μεταφοράς κάθετα, αργά αλλά σταθερά και χωρίς στροφή, μέχρι τη διάτρηση του καουτσούκ βιασύνης.
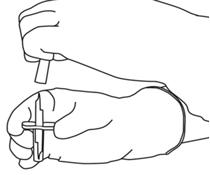
- Επιστρέψτε τα δύο μπουκάλια έτσι ώστε το νερό για τα ενέσιμα παρασκευάσματα να μπορεί να γεμίσει πλήρως τη φιάλη που περιέχει τη φιάλη που περιέχει τη φιάλη που περιέχει τη σκόνη της φιάλης.
- Αφαιρέστε το κενό μπουκάλι που περιείχε το νερό για ενέσιμα παρασκευάσματα ταυτόχρονα με τον σωληνίσκο μεταφοράς.
Μπορούν να πεταχτούν.
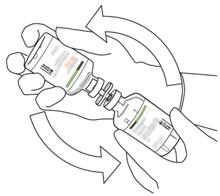
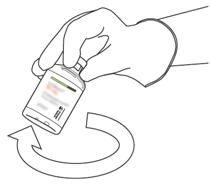
- Πάρτε το μπουκάλι που περιέχει την ανασυσταθείσα διάλυμα της ακτίνων και απαλά Agite μέχρι να διαλύσει τα πάντα παραμένει σκόνη, αλλά να μην ανακατεύει, δεν θα ανακατεύει, που δεν θα ανακατεύει, αυτό θα μουρσήσει.
Εάν υπάρχουν φυσαλίδες, αφήστε τη λύση να σταθεί για λίγα λεπτά και να περιμένει την εξαφάνιση των φυσαλίδων.
- Η ανασυσταθείσα διάλυμα αντιπροσωπεύει 1 mg/ml αλτεπλάσης. Πρέπει να είναι καθαρό και άχρωμο, ακόμη και ανοιχτό κίτρινο και δεν πρέπει να περιέχει σωματίδια.
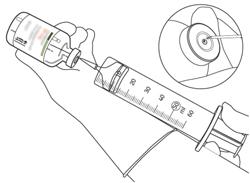
- Πάρτε την ποσότητα που απαιτείται μόνο από μια βελόνα και μια σύριγγα.
Μην χρησιμοποιείτε την ίδια οπή διάτρησης με αυτή του σωληνίσκου μεταφοράς για να αποφύγετε οποιαδήποτε διαρροή.
- Χρησιμοποιήστε αμέσως. | δεν χρησιμοποιείται.
Ne conservez pas la solution non utilisée.
συνταγή/απελευθέρωση/φροντίδα |
Λίστα I
| Φαρμακευτική αγωγή που προορίζεται για νοσοκομειακή χρήση και για χρήση σε κατάσταση έκτακτης ανάγκης σύμφωνα με το άρθρο R.5121-96 του Κώδικα Δημόσιας Υγείας. |
| AMM | 3400955718 06.09.2024) 10 mg. |
| 3400955852933 (1987, RCP Rev 06.09.2024) 20 mg. |
| 3400955853015 (1987, RCP Rev 06.09.2024) 50 mg. |